有 X、Y、Z、W四种元素,其中X是周期表中原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)由X、Y 构成的10电子化合物的分子式 ;基态 Y原子的核外电子排布式为 。
(2)离子Z3—的中心原子轨道杂化类型为 ,离子Z3—的空间构型为 ;
(3)化合物ZX3的沸点比化合物YX4的高,其主要原因是
;
(4)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(5)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 ,它可与浓盐酸发生非氧化还原反应,生成配合物H2WCl3,反应的化学方程式为
。
(1) 反应: 2A(g)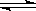 B(g ) xC(g) 在一定的条件下达到平衡状态, 密闭容器中的压强增大P%, 测得A的转化率为 P%, 则x的值为 __________.
B(g ) xC(g) 在一定的条件下达到平衡状态, 密闭容器中的压强增大P%, 测得A的转化率为 P%, 则x的值为 __________.
(2) 在容积相同的两密闭容器A和B中, 保持温度为 423K, 同时向A和B中分别加入 a mol 和 b mol 的HI(a > b), 待反应: 2HI(g)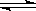 H2(g)+ I2(g)到平衡后, 用 “ > < 或 ="”" 回答下列问题:
H2(g)+ I2(g)到平衡后, 用 “ > < 或 ="”" 回答下列问题:
从反应开始到达到平衡所需要时间: tA _______ tB(填>,<, ="," 下同)
平衡时的碘的浓度: c(I2 )Ac(I2 )B
HI的平衡分解百分率为:  .
.
红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据下图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式;
(2)PCl5分解生成PCl3和Cl2的热化学方程式;
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2α1 (填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是;
(4)P和Cl2分两步反应生成1mol PCl5的△H3=。
一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下
反应:3A(g)+B (g) xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。
①1min内,B的平均反应速率为;x="" _________;
②若反应经2min达到平衡,平衡时C的浓度__0.8mol/L(填“大于”、“等于”或“小于”);
③改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,
起始加入的三种物质的物质的量a、b、c之间应满足的关系式
。
(2)若维持容器压强不变,改变起始物质加入的量,欲使反应达到平衡时C的物质
的量分数与原平衡相等,则起始应加入的A、B物质的量:____molA气体和2molB气体。
有pH=4的盐酸、硫酸、醋酸三瓶溶液:(以下均用>、<、=表示)
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是。
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为υ1、υ2、υ3,则其关系是;反应过程中放出H2的速率依次为υa、υb、υc,则其关系是
根据下列有机化合物,回答问题。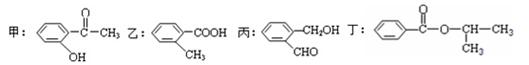
(1)上述互为同分异构体的化合物为;
(2)写出丙中官能团的名称;
(3)丁在一定条件下,可以发生水解反应,生成X、Y两种物质(相对分子质量:X<Y)。由X经下列反应可制得N、F两种高分子化合物,它们都是常用的塑料。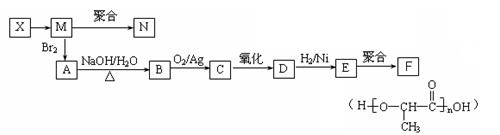
(ⅰ)X转化为M的反应类型是。写出N的结构简式:
(ⅱ)写出B转化为C的化学方程式;
(ⅲ)在一定条件下,E分子能脱去水形成多种化合物:
①请写出两分子E脱去一分子水的反应的化学方程式;
②在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式为。