某学生欲用已知物质的量浓度的醋酸来测定未知物质的量浓度的氢氧化钠溶液时,选择适当的指示剂。请填写下列空白:
(1)用标准醋酸滴定待测的氢氧化钠溶液时,从下列选项中选出最恰当的一项________。
| |
锥形瓶中溶液 |
滴定管中溶液 |
选用指示剂 |
选用滴定管 |
| A |
碱 |
酸 |
石蕊 |
(乙) |
| B |
酸 |
碱 |
甲基橙 |
(甲) |
| C |
碱 |
酸 |
酚酞 |
(甲) |
| D |
酸 |
碱 |
石蕊 |
(乙) |
滴定时应左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 。直到加入一滴醋酸后,溶液颜色由 色变为 色,并在半分钟内溶液颜色不改变为止。
(2)下列操作中可能使所测氢氧化钠溶液的浓度值偏低的是 。
A.酸式滴定管未用标准醋酸润洗就直接注入标准醋酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取醋酸体积时,开始仰视读数,滴定结束后俯视读数
(3)某学生根据3次实验分别记录有关数据如表:
| |
待测氢氧化钠 |
0.100mol/L醋酸的体积 |
|
| 滴定次数 |
溶液的体积(ml) |
滴定前的刻度(ml) |
滴定后的刻度(ml) |
| 第一次 |
25.00 |
0.00 |
24.98 |
| 第二次 |
25.00 |
1.56 |
27.86 |
| 第三次 |
25.00 |
0.22 |
25.24 |
依据上表数据计算该氢氧化钠溶液的物质的量浓度为 。
(4)下图为上述25 mL NaOH溶液中逐滴滴加CH3COOH溶液过程中溶液pH的变化曲线,请回答:
①B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?________(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间.(若正确,此问不答)。
②在D点时,溶液中c(CH3COO-)+c(CH3COOH)________2c(Na+)。(填“>”、“<”或“=”)
【选修3:物质结构与性质】
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为____________________________。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C________(填“>”或“<”,下同)B;第一电离能:N________O,原因是_________________________。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为_________________形,其中硫原子采用______________杂化,写出SO42-的一种等电子体的化学式:______________________。
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图所示(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围___________个O2-相紧邻。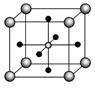
(5)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71 g·cm-3,晶胞边长为4.28×10-10 m,则FexO中x=__________(用代数式表示,不要求算出具体结果)。
【选修2:化学与技术】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为___________。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的____________________操作。
(3)浸出液“净化”过程中加入的主要物质为___________ ,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为___________。
铁及其化合物在工农业生产、环境保护等领域中有着重要的作用。
(1)酸性条件下,硫酸亚铁可将MnO2还原为MnSO4,该反应的离子方程式为:_____________。
(2)分析表明,铁在浓硫酸中发生钝化时,生成的氧化物中Fe、O两种元素的质量比为28∶11,则其化学式为______________。
(3)铁及其化合物可用于消除环境污染。常温下,硫酸亚铁能将SO2转化为SO42-,总反应为2SO2+O2+2H2O=2H2SO4,其中一个反应为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为____________________。
常温下,用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2反应可生成0.5 mol N2,则y=____________。
(4)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。通电电解,然后通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2CO32-+H2S=2[Fe(CN)6]4-+2HCO3-+S↓。电解时,阳极的电极反应式为___________;电解过程中阴极区溶液的pH______________(填“变大”、“变小”或“不变”)。
0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为 。若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2.2—二甲基丁烷,则此烃属于 烃,结构简式为 ,名称是 。
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖。在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。例如二乙醚的结构简式为:CH3—CH2—O—CH2—CH3,其核磁共振谱中给出的峰值(信号)有两个,如图所示:
(1) 下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是 。
| A.CH3CH3 | B.CH3COOH |
| C.CH3COOCH3 | D.CH3OCH3 |
(2) 化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如右图所示,则A的结构简式为: ,请预测B的核磁共振氢谱上有 个峰(信号)。
(3)用核磁共振氢谱的方法来研究C2H6O的结构,简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是 。