如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略。将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间。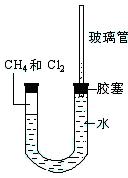
(1)经过几个小时的反应后,U型管左端产生的现象是: _______、_______、______右端的玻璃管中水柱变化是 。
A.升高 B.降低 C.不变 D.无法确定
(2)试解释U型管右端的玻璃管中水柱变化的原因 。
(3)在反应生成物中:常用作有机溶剂的是_______,常用作灭火剂的是__ ,
______分子只有一种结构的事实能有效证明CH4是 结构而非平面正方形结构。
(4)假设甲烷与氯气充分反应,且只产生一种有机物,请写出化学方程式 。
(5)写出符合下列条件的甲烷的一种同系物的结构简式
A.氢原子数为十八 B.一氯取代物只有一种结构
(8分)有四种常见药物 ①阿司匹林 ②青霉素 ③胃舒平 ④麻黄碱。请回答:
(1)某同学胃酸过多,应选用的药物是(填序号,下同)。
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是。
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是。
(4)滥用药物会导致不良后果,如过量服用会出现水杨酸中毒,应立即停药,并静脉注射NaHCO3溶液。
(8分)我国目前使用最多的燃料是煤、石油、天然气,它们都是燃料。造成环境污染的SO2,主要是燃烧产生的,它与空气中的水蒸气结合可以变成,随雨降到地面,会使土壤而伤害农作物。
下表是不同温度下水的离子积的数据:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积 |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),做此判断的理由是____________________________________________________________.
(2)25℃时,某Na2SO4溶液中c(SO)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________.
(3)在t2温度下测得某溶液pH=7,该溶液显______(填“酸”、“碱”或“中”)性.将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合.
①若所得混合液为中性,则a∶b=________.
②若所得混合液pH=2,则a∶b=________.
氨的合成原理为:N2(g)+3H2(g) 2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如右图。回答下列问题:
2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如右图。回答下列问题: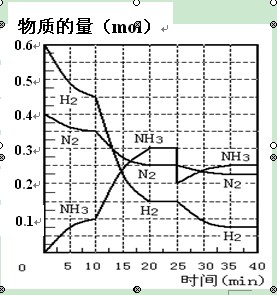
(1)10 min内以NH3表示的平均反应速率;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
| A.加了催化剂 | B.缩小容器体积 | C.降低温度 | D.增加NH3物质的量 |
(3)第1次平衡的时间范围为:平衡常数K1 ="_____________" (表达式),第2次平衡时NH3的体积分数 ;
(4)在反应进行至25 min时, 曲线发生变化的原因:
I、现有下列电解质溶液:① Na 2CO3 ② NaHCO3 ③苯酚钠(不与碱反应) ④CH3COONH4 ⑤NH4HCO3
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号):
(2)已知:酸性H2CO3 > 苯酚> HCO3-。常温下,物质的量浓度相同的① 、②、 ③溶液pH大小顺序为(填写序号):
(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式
(4)已知常温下CH3COONH4溶液呈中性,根据这一事实推测⑤溶液的pH7(填>、=或<), 理由是:
II、室温时,向a mL 0.10 mol/L的稀氨水中逐滴加入 b mL 0.10 mol/L的稀盐酸,试分析:
(1)当b=a时,溶液呈________(填“酸”“碱”或“中”)性,此时溶液中,c(NH)________(填“>”“<”或“=”)c(Cl-).
(2)当溶液呈中性时,a________(填“>”“<”或“=”)b,此时溶液中c(NH)________c(Cl-)(同上).