在一体积固定的密闭容器中进行下列反应:2SO2+O2 2SO3(g),当反应达到平衡时SO2、O2、SO3的浓度分别为0.2 mol·L-1,0.1 mol·L-1,0.2 mol·L-1,则反应起始时的部分物质的数据不可能是
2SO3(g),当反应达到平衡时SO2、O2、SO3的浓度分别为0.2 mol·L-1,0.1 mol·L-1,0.2 mol·L-1,则反应起始时的部分物质的数据不可能是
| A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1 | B.SO2为0.25 mol·L-1 |
| C.SO2,SO3均为0.15 mol·L-1 | D.SO3为0.4 mol·L-1 |
星际空间存在着以分子形式存在的星际物质。下表为某些星际分子发现年代列表,下列有关说法正确的是
| 发现年代 |
1971年 |
1976年 |
1977年 |
1978年 |
1982年 |
| 星际分子 |
氰基乙炔 (HC3N) |
氰基丁二炔 (HC5N) |
氰基己三炔 (HC7N) |
氰基辛四炔 (HC9N) |
氰基癸五炔 (HC11N) |
A.五种氰基炔互为同素异形体
B.它们都属于烃的衍生物
C.五种氰基炔互为同系物
D.HC11N属于高分子化合物
下列说法正确的是
| A.烃的衍生物是指由烃经一步反应得到的有机生成物 |
| B.由烃经一步反应得到的有机生成物是烃的衍生物 |
| C.烃的衍生物中不一定有氧、氢等元素 |
| D.卤代烃中一定有碳、氢、卤素三种元素 |
化学与生活、社会密切相关。下列说法不正确的是
| A.乙醇是一种再生能源,充分燃烧的产物不污染环境 |
| B.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多 |
| C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D.提倡人们购物时不用塑料袋,是为了防止白色污染 |
已知:N2O4(g) 2NO2(g)ΔH=+52.70 kJ·mol—1。在恒温、恒容的密闭容器中进行上述反应,达到平衡时,描述中不正确的是
2NO2(g)ΔH=+52.70 kJ·mol—1。在恒温、恒容的密闭容器中进行上述反应,达到平衡时,描述中不正确的是
| A.若再向容器内继续通入少量N2O4,则平衡向正反应方向移动 |
| B.新平衡时,NO2的体积分数小于原平衡时NO2的体积分数 |
| C.新平衡时,容器中气体的平均相对分子质量比原平衡大 |
| D.新平衡时,混合气体颜色变浅,容器中气体的密度增大 |
一定温度下,将1molA和1molB气体充入2L恒容密闭容器,发生A(g)+ B(g)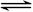 xC(g)+D(s),t1时达到平衡,在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示,正确的是
xC(g)+D(s),t1时达到平衡,在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示,正确的是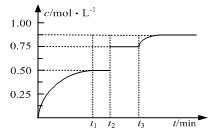
| A.方程式中x=1 | B.t2时刻改变是使用催化剂 |
| C.t3时刻改变是移去少量物质D | D.t1~t3间该反应的平衡常数均为4 |