为了证明化学反应有一定的限度,进行了如下探究活动:
(Ⅰ)取5mL0.1 mol·L-1的KI溶液,滴加0.1 mol·L-1的FeCl3溶液5~6滴
(Ⅱ)继续加入2mLCCl4振荡
(Ⅲ)取萃取后的上层清液,滴加KSCN溶液
(1)探究活动(Ⅰ)和(Ⅱ)的实验现象分别为_____________、 。
(2)在探究活动(Ⅲ)中,活动设计者的意图是通过生成血红色的Fe(SCN)3,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中,却未见溶液呈血红色,对此同学们提出了下列两种猜想。
猜想一:Fe3+已全部转化为Fe2+
猜想二:生成Fe(SCN)3浓度极小,其颜色肉眼无法观察
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高
结合新信息,请你设计以下实验验证猜想
①请将相关的实验操作、现象和结论填入下表
| 实验操作 |
现象 |
结论 |
| 步骤一: |
产生蓝色沉淀 |
|
| 步骤二: |
|
“猜想二”成立 |
②写出操作“步骤一”中发生反应的离子方程式
(14分)纤维素是自然界最为丰富的可再生的天然高分子资源。
(1)纤维素可制备用于纺织、造纸等的黏胶纤维〔成分是(C6H10O5)n〕,生产过程涉及多个化学反应。工艺简图如下:
近来,化学家开发了一种使用NMMO加工纤维素的新方法,产品“Lyocell纤维”成分也是(C6H10O5)n。工艺流程示意图如下: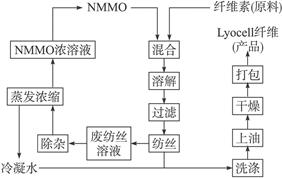
①“Lyocell纤维”工艺流程中,可充分循环利用的物质是________。
②与“Lyocell纤维”工艺相比,黏胶纤维工艺中会产生含有________ (只填非金属元素符号)的废物,并由此增加了生产成本。
③“Lyocell纤维”被誉为“21世纪的绿色纤维”,原因是_______________________________。
(2)“Lyocell纤维”工艺流程中的NMMO可按如下路线制备(反应条件均省略):
其中,化合物Ⅰ可三聚为最简单的芳香烃,化合物Ⅱ可使溴水褪色。
①化合物Ⅰ也可聚合为在一定条件下具有导电性的高分子化合物,该高分子化合物的化学式为___________。
②化合物Ⅱ与氧气反应的原子利用率达100%,其化学方程式为________________。
③关于化合物Ⅲ、Ⅳ的说法正确的是________ (填代号)。
| A.都可以发生酯化反应 |
| B.Ⅲ可被氧化,Ⅳ不可被氧化 |
| C.都溶于水 |
| D.Ⅲ可与钠反应,Ⅳ不可与钠反应 |
E.Ⅲ是乙醇的同系物
F.Ⅲ可由卤代烃的取代反应制备
④写出合成NMMO最后一步反应的化学方程式________________________________。
有机黏合剂是生产和生活中一类重要的材料。黏合过程一般是液态的小分子黏合剂经化学反应转化为大分子或高分子而固化。
(1)“502胶”是一种快干胶,其主要成分是α氰基丙烯酸乙酯,其结构简式为:
在空气中微量水催化作用下发生加聚反应,迅速固化而将被粘物粘牢。请写出“502胶”发生黏合过程的化学方程式:________________________________________________________。
(2)厌氧胶也是一种黏合剂,其结构简式为:
它在空气中稳定,但在隔绝空气(缺氧)时,分子中双键断开发生聚合而固化。工业上用丙烯酸和某种物质在一定条件下反应可制得这种黏合剂。这一制取过程的化学方程式为:
______________________________________________________________________________。
(3)白乳胶是常用的黏合剂,其主要成分为醋酸乙烯酯(CH3COOCH==CH2),它有多种同分异构体,其中同时含有“—CHO”和“—CH==CH—”结构的同分异构体共有五种,如“CH3—CH==CH—O—CHO”和“CH2==CH—CH2—O—CHO”,请写出另外三种同分异构体的结构简式(已知含有 结构的物质不能稳定存在):
结构的物质不能稳定存在):
_______________________、_______________________、_______________________。
(22分)我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。PETG的结构简式为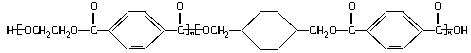
已知:Ⅰ.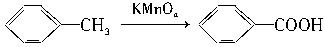
Ⅱ.RCOOR1+R2OH→RCOOR2+R1OH(R1、R2表示烃基)这种材料合成路线如下: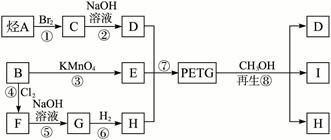
试完成下列问题:
(1)合成PETG的单体有_____________________种。
(2)写出A、B、I的结构简式:A _____________________,B _____________________,I _____________________。
(3)G属于酚类的同分异构体有多种,其中酚羟基互为间位的同分异构体有_________种。
(4)反应⑦中参加反应的D、E、H的物质的量之比为_____________________。
苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。已知:
(1)写出C的结构简式__________________________________________。
(2)写出反应②的化学方程式__________________________________________。
(3)写出G的结构简式_____________________。
(4)写出反应⑧的化学方程式__________________________________________。
(5)写出反应类型:④_____________________,⑦_____________________。
(6)下列可检验阿司匹林样品中混有水杨酸的试剂是_____________________。
a.FeCl3溶液 b.NaHCO3溶液 c.石蕊试液
有A、B、C、D四种无色溶液,它们分别是葡萄糖溶液、蔗糖溶液、淀粉液、甲酸乙酯中的一种。经实验可知:
(1)B、C均能发生银镜反应。
(2)A遇碘水变蓝色。
(3)A、C、D均能发生水解反应,水解液均能发生银镜反应。
试判断它们各是什么物质?