(14分)纤维素是自然界最为丰富的可再生的天然高分子资源。
(1)纤维素可制备用于纺织、造纸等的黏胶纤维〔成分是(C6H10O5)n〕,生产过程涉及多个化学反应。工艺简图如下:
近来,化学家开发了一种使用NMMO加工纤维素的新方法,产品“Lyocell纤维”成分也是(C6H10O5)n。工艺流程示意图如下: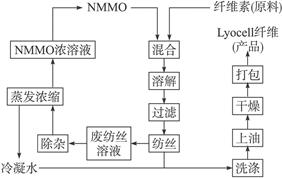
①“Lyocell纤维”工艺流程中,可充分循环利用的物质是________。
②与“Lyocell纤维”工艺相比,黏胶纤维工艺中会产生含有________ (只填非金属元素符号)的废物,并由此增加了生产成本。
③“Lyocell纤维”被誉为“21世纪的绿色纤维”,原因是_______________________________。
(2)“Lyocell纤维”工艺流程中的NMMO可按如下路线制备(反应条件均省略):
其中,化合物Ⅰ可三聚为最简单的芳香烃,化合物Ⅱ可使溴水褪色。
①化合物Ⅰ也可聚合为在一定条件下具有导电性的高分子化合物,该高分子化合物的化学式为___________。
②化合物Ⅱ与氧气反应的原子利用率达100%,其化学方程式为________________。
③关于化合物Ⅲ、Ⅳ的说法正确的是________ (填代号)。
| A.都可以发生酯化反应 |
| B.Ⅲ可被氧化,Ⅳ不可被氧化 |
| C.都溶于水 |
| D.Ⅲ可与钠反应,Ⅳ不可与钠反应 |
E.Ⅲ是乙醇的同系物
F.Ⅲ可由卤代烃的取代反应制备
④写出合成NMMO最后一步反应的化学方程式________________________________。
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: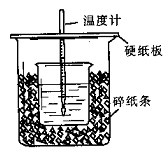
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),
简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”)。
(12分)化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置。完成下列问题: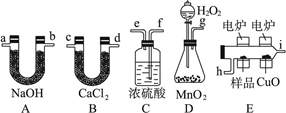
(1)产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是________________。
(2)C装置中浓硫酸的作用是____________。(3)D装置中MnO2的作用是__________________。
(4)燃烧管中CuO的作用是__________________。
(5)若准确称取0.9 g样品(只含C、H、O三种元素中的两种或三种)经充分燃烧后,A管质量增加1.32 g,B管质量增加0.54 g,则该有机物的实验式为__________________________。
(6)若该有机物溶于水,其分子式中氢原子为4,则其结构简式为______________。
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.5 g。
步骤Ⅱ 将样品溶解在250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)上述操作步骤Ⅱ是否正确________(填“是”或“否”);若不正确,请改正_______________________________________________。(若正确,此空不填)
(2)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察________。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,溶液最终变成____________色。
(3)滴定结果如下表所示:
| 滴定 次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.101 0 mol/L,则该样品中氮的质量分数为________。
某实验小组的同学为探究一氧化氮的性质,欲选用下列实验装置来制取一氧化氮。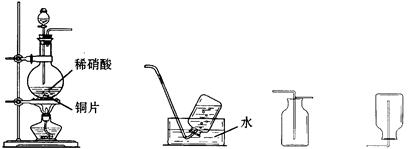
A B C D
请回答下列问题:
(1)用上图中所示的装置制取一氧化氮,选用仪器连接的顺序应是A接_________。
(2)现欲用15 mol/L HNO3溶液配制500 mL、1 mol/L HNO3溶液时,要用到的仪器除烧杯、胶头滴管、玻璃棒、量筒外,还必须使用的一种玻璃仪器是。
(3)稀硝酸具有强氧化性,在常温下就可以和铜发生反应生成一氧化氮气体,写出该反应的化学方程式:___________________________________________________。
(4)实验开始时,该小组同学发现在烧瓶中有红棕色气体产生,请你用化学方程式来表示产生这种现象的原因:_________________________________________________。
(5)一氧化氮和一氧化碳是汽车尾气中的主要污染物。目前,汽车尾气已成为许多大城市空气的主要污染源。治理汽车尾气中的NO和CO的一种方法是:在汽车的排气管上装一个催化转化装置,使NO与CO反应,生成CO2和N2。反应的化学方程式是。
某只含有CaCl2和Na2SO4杂质的粗盐样品,加水得到混合物A后,某实验小组的同学设计了如下实验步骤,请按要求回答有关问题。
(1)在混合物A中先加过量的BaCl2溶液除去的离子是;充分搅拌后,再加过量的Na2CO3溶液可除去的离子是。
(2)在溶液C中加入的足量试剂X是 。
(3)操作②的分离方法分别是。
(4)漂白液的有效成分是NaClO,可用气体F与NaOH溶液反应制得,该反应的化学方程式为。