(12分)化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置。完成下列问题:
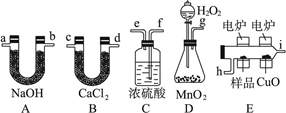
(1)产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是________________。
(2)C装置中浓硫酸的作用是____________。(3)D装置中MnO2的作用是__________________。
(4)燃烧管中CuO的作用是__________________。
(5)若准确称取0.9 g样品(只含C、H、O三种元素中的两种或三种)经充分燃烧后,A管质量增加1.32 g,B管质量增加0.54 g,则该有机物的实验式为__________________________。
(6)若该有机物溶于水,其分子式中氢原子为4,则其结构简式为______________。
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:
| 实验方案 |
实验现象 |
||||
| ①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞。 ②向新制的H2S饱和溶液中滴加新制的氯水 ③钠与滴有酚酞试液的冷水反应 ④镁带与2mol/L的盐酸反应 ⑤铝条与2mol/L的盐酸反应 |
E.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的: 。
(2)实验用品:仪器、材料: 略药品: 略
(3)实验内容:用序号填写下表中的实验方案,并完成相关的离子方程式
| 实验方案 |
实验现象 |
有关离子方程式 |
| A |
||
| B |
不填 |
|
| C |
不填 |
|
| D |
不填 |
|
| E |
(4)实验结论:____________________________________________________。
(5)请用原子结构理论解释上述结论的原因___________________________
(1)如图,若烧瓶是干燥的。当烧瓶口向上时,由A口导入气体,可收集下列中的(填序号,下同)气体。若烧瓶充满水,可收集下列中的________气体。
①NO ②NH3 ③SO2 ④NO2
(2)若烧瓶中事先已集满一瓶氨气,并将烧瓶口向下放置,由______口导入气体可收集NO气体,其原因是 __________________________________________________。
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。已知
①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点(℃) |
34.7 |
78.5 |
118 |
77.1 |
请回答:
(1)浓硫酸的作用是___________、___________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式。
(2)球形干燥管C的作用是___________、____________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)___________________;反应结束后D中的现象是_____________、_______________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,__________(填操作名称)后,除去_______________;然后对液体混合物进行蒸馏,收集________℃左右的馏分,以得到较纯净的乙酸乙酯。
有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某同学设计了如图装置(夹持装置仪器已省略),其实验操作为:按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻。然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。试回答以下问题:
(1) A中发生反应的化学方程式:,
B的作用:;C中热水的作用:。
(2) M处发生反应的化学方程式为:。
(3) M管中可观察到的现象:,从中可认识到该实验过程中催化剂(填“参加”或“不参加”)化学反应,还可以认识到催化剂起催化作用需要一定的。
(4) 验证乙醇氧化产物的试剂是,并写出对应的化学方程式。
(5) 若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有,要除去该物质,可先在混合液中加入(填写字母)。
a、氯化钠溶液 b、苯 c、碳酸氢钠溶液 d、四氯化碳
资料显示:“氨气可在纯氧中安静燃烧……某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。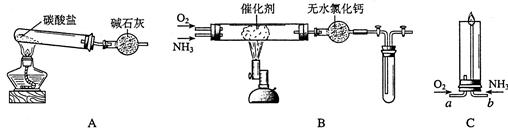
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是;碱石灰的作用是。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是
试管内气体变为红棕色,该反应的化学方程式是
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中。试管内气体颜色变浅,请结合化学方程式说明原因
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通人到装置C中,并在b管上端点燃氨气,两气体通入的先后顺序是,其理由是