有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某同学设计了如图装置(夹持装置仪器已省略),其实验操作为:按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻。然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。试回答以下问题:
(1) A中发生反应的化学方程式: ,
B的作用: ;C中热水的作用: 。
(2) M处发生反应的化学方程式为: 。
(3) M管中可观察到的现象: ,从中可认识到该实验过程中催化剂 (填“参加”或“不参加”)化学反应,还可以认识到催化剂起催化作用需要一定的 。
(4) 验证乙醇氧化产物的试剂是 ,并写出对应的化学方程式 。
(5) 若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有 ,要除去该物质,可先在混合液中加入 (填写字母)。
a、氯化钠溶液 b、苯 c、碳酸氢钠溶液 d、四氯化碳
某同学设计的制取氯气和验证氯气部分化学性质的实验装置如下图甲所示:
其中D处放有干燥的紫色石蕊试纸,E处放有湿润的紫色石蕊试纸, F、G处依次放有喷上少量淀粉KI溶液、浓NaOH溶液的棉球。回答下列问题:
(1)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,请写出A处反应的离子方程式:
(2)B处饱和食盐水是为了除去,C处浓硫酸的作用是。
(3)实验中可观察到颜色的变化:D处,E处,F处,G处棉球的作用是,G处反应的离子方程式。
(4)当F处棉球变色,立即关闭活塞K,可看到I瓶中液面上升,H瓶中充满黄绿色气体。则H瓶中加入的液体一般为,甲中H—I装置的作用为。若将甲中的H—I装置置换为乙装置,是否可行(填“是”或“否”),理由是。
选择下列实验方法分离物质,将分离方法的序号填在横线上
A、萃取分液法 B、加热分解 C、结晶法D、分液法E、蒸馏法 F、过滤法
(1)分离饱和食盐水和沙子的混合物
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾
(3)分离水和汽油的混合物
(4)分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C),已知四氯化碳和甲苯互溶
二氯化二硫(
)在工业上用于橡胶的硫化。为在实验室合成
,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~ 140℃与硫反应,即可得
粗品。
②有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
化学性质 |
| 112.8 |
444.6 |
略 |
|
| -77 |
137 |
遇水生成
、
、
; 300℃以上完全分解; 
|
设计实验装置图如下:
(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见。
利用改进后的正确装置进行实验,请回答下列问题:
(2)
中反应的离子方程式;
E中反应的化学方程式:。
(3)
中的试剂分别是_、。
(4)仪器
的名称分别是、,F的作用是。
(5)如果在加热
时温度过高,对实验结果的影响是,
在F中可能出现的现象是。
(6)
粗品中可能混有的杂质是(填写两种)、,为了提高
的纯度,关键的操作是控制好温度和。
在室温和大气压强下,用图示的装置进行实验,测得
含
90%的样品与水完全反应产生的气体体积
。现欲在相同条件下,测定某电石试样中
的质量分数,请回答下列问题: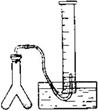
(1)
和水反应的化学方程式是。
(2)若反应刚结束时,观察到的实验现象如图所示,这时不能立即取出导气管,理由是。
(3)本实验中测量气体体积时应注意的事项有。
(4)如果电石试样质量为
,测得气体体积为
,则电石试样中
的质量分数计算式
(
)=。(杂质所生成的气体体积忽略不计)。
以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、泥三角、玻璃棒、药匙、托盘天平
实验步骤:
①准确称量一个干净、干燥的坩埚;
②在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量过的试样放入研钵中研细,再放回到坩埚中;
③将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是;
(2)指出实验步骤中存在的错误并改正:;
(3)硫酸钠不能放置在空气中冷却的原因是;
(4)步骤⑤的目的是;
(5)下面的情况有可能造成测试结果偏高的是(填序号)。
| A. | 试样中含有加热不挥发的杂质 |
| B. | 试样中含有加热易挥发的杂质 |
| C. | 测试前试样已有部分脱水 |
| D. | 实验前坩埚未完全干燥 |
E.晶体加热脱水不完全
F.加热时晶体溅出