某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:
| 实验方案 |
实验现象 |
||||
| ①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞。 ②向新制的H2S饱和溶液中滴加新制的氯水 ③钠与滴有酚酞试液的冷水反应 ④镁带与2mol/L的盐酸反应 ⑤铝条与2mol/L的盐酸反应 |
E.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的: 。
(2)实验用品:仪器、材料: 略 药品: 略
(3)实验内容:用序号填写下表中的实验方案,并完成相关的离子方程式
| 实验方案 |
实验现象 |
有关离子方程式 |
| |
A |
|
| |
B |
不填 |
| |
C |
不填 |
| |
D |
不填 |
| |
E |
|
(4)实验结论:____________________________________________________。
(5)请用原子结构理论解释上述结论的原因___________________________
某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验。 
(1)能说明有SO2气体产生的实验现象是。
(2)图2中导气管e的主要作用为。
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:
。
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是。
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为确认溶液的成分,选用如下试剂:
| A.稀HCl溶液 | B.稀硫酸 | C.KSCN溶液 | D.酸性KMnO4溶液 |
E.NaOH溶液 F.H2O2溶液
试完成下列相关的实验探究:
实验步骤 |
实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 |
(1) ,则说明Ⅱ成立。 (2) ,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立。 |
| 2、 |
。 |
某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上.某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在.
所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O.
该小组探究过程如下:
●查阅资料:
| ①镁、铝、锌都是银白色的金属; ②锌(Zn)可以与NaOH溶液反应生成H2; ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O; ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+. |
● 提出假设:
(1)假设①:该混合金属粉末中除镁外还含有________元素
假设②:该混合金属粉末中除镁外还含有________元素
假设③:该混合金属粉末中除镁外还含有铝、锌元素
●实验探究:
甲同学基于假设③设计实验方案如下:
乙同学同样基于假设3设计另一实验方案如下:
(2)试剂M是____________,沉淀B是_____________.
(2)试剂M是____________,沉淀B是_____________.
(3)丙同学认为乙同学的方案比甲同学的好,理由是_______________________.
(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是____________________________.
(5)操作Ⅰ的主要过程是:在滤液中逐滴加入_______________,直至生成的沉淀刚好溶解,再加入足量的____________________.
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。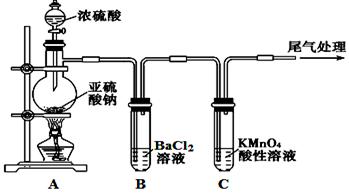
已知:Na2SO3+H2SO4(浓)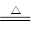 Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是。
(2)实验过程中,C中的现象是,说明SO2具有性。
(3)实验过程中,观察到装置B中出现了明显的白色沉淀。为探究该白色沉淀的成分,该小组同学进行了如下实验: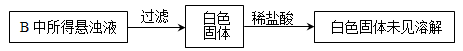
根据实验事实判断该白色沉淀的成分是(填化学式),产生该白色沉淀的原因可能是(填字母编号)。
a.BaSO3既不溶于水也不溶于酸
b.BaCl2溶液中可能溶解有氧气
c.BaCl2溶液中可能混有NaOH
d.由A制得的SO2气体中可能混有氧气
(4)写出B中产生白色沉淀的离子方程式为:____________________________
(5)如果将装置A中的浓H2SO4换作浓HNO3,对此实验是否有影响并明理由。
为探索工业废料的再利用,某化学兴趣小组设计了如下左图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。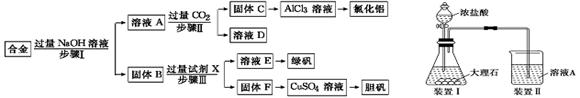
请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是,该操作中除用到烧杯和玻璃棒外,还必须用到的玻璃仪器有。
(2)试剂X是
(3)步骤Ⅱ中发生反应的离子方程式是:_______________________________________
(4)进行步骤Ⅱ时,该小组用如上右图所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,为了避免固体C减少,改进的措施是在装置Ⅰ、Ⅱ之间增加一个________________________________________。
(5)溶液D中各离子的浓度由大到小的顺序为:__________________________________
(6)工业上由X和F制得CuSO4,还必须使用的最恰当的试剂可以是_____或_________。
| A.浓H2SO4 | B.Fe2O3 | C.HNO3 | D.O2 E.H2O2 |
(7)从溶液E中获得绿矾晶体的实验操作依次为(填操作名称)、冷却结晶、过滤洗涤。
某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
Ⅰ.实验装置如下图1所示
图1图2
(1)浓硝酸受热分解的化学方程式是 。
(2)实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确?(填“正确”或“不正确),理由是。
Ⅱ.实验装置如上图2所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,该反应的化学方程式是。
(2)当集气瓶中充满红棕色气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?(填“正确”或“不正确”),理由是。
Ⅲ.为了更直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。