某只含有CaCl2和Na2SO4杂质的粗盐样品,加水得到混合物A后,某实验小组的同学设计了如下实验步骤,请按要求回答有关问题。
(1)在混合物A中先加过量的BaCl2溶液除去的离子是 ;充分搅拌后,再加过量的Na2CO3溶液可除去的离子是 。
(2)在溶液C中加入的足量试剂X是 。
(3)操作②的分离方法分别是 。
(4)漂白液的有效成分是NaClO,可用气体F与NaOH溶液反应制得,该反应的化学方程式为 。
如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为_________________________________________;
②乙中总反应的离子方程式为___________________________________________;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为_______________________________________________________。
(2)若甲 、乙两烧杯中均盛有CuSO4溶液。
、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为___________________________________________;
②如果起始时乙中盛有200mLpH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入______________(填写物质的化学式)_______________g。
某校化学实验兴趣小组欲采用如图所示的实验装置制备Cl2,同时进行与氯气有关的某些实验,按要求回答问题。
(1)A是浓盐酸,B为二氧化锰,将A滴入B中时发生反应的 离子方程式为______________________________________________;
离子方程式为______________________________________________;
(2)甲同学用含有0.2molHCl的浓盐酸与 足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下)小于1.12L,这是由于反应过程中盐酸浓度变小造成的。请列举导致盐酸浓度变小的原因:___________________________________________________。
足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下)小于1.12L,这是由于反应过程中盐酸浓度变小造成的。请列举导致盐酸浓度变小的原因:___________________________________________________。
(3)在实验室中,乙同学欲用下图中的装置净化氯气,则瓶①②中应盛放的试剂分别是①_________________________,②_________________________(填试剂名称)。
(4)丙同学将纯净的Cl2通入一定量石灰乳中来制取漂白粉,若通入224mL(标准状况下)Cl2完全反应,则反应过程中转移电子的 物质的量为____________________。
物质的量为____________________。
某课外小组同学设计了下列实验装置,通过测定某些装置中试剂的质量变化,探究某孔雀石[化学式为aCuCO3·bCu(OH)2,a、b为正整数]中各元素的质量关系。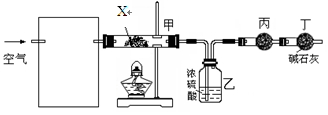
①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;(注:碱石灰可看作烧碱和生石灰的混合物)
②向装置中鼓入空气的目的是__ ________;
丙装置中药品的名称为________,
实验时,该药品未见明显变化,证明____________________________________________;
③连续两次加热、鼓气、冷却、称量甲装置的质量,质量差不超过0.1 g,判断该孔雀石已完全分解。
④更精确的测定得出如下数据:孔雀石受热后完全分解,固体由16.52 g变为12.00 g,装置乙增重1.44 g。写出该孔雀石的化学式________________________。
某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
(1)在一个质量为ag的蒸发皿中加入一些样品,称得总质量为bg。用酒精灯对其充分加热,冷却后称得其总质量为cg。残留在蒸发皿中的固体是(填化学式)_________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。为了保证实验成功,所选用针筒的最大刻度值应大于或等于_________(mL)。(设实验在标准状况下进行,请把合适的答案编号都挑选出来)
| A.[(b-a)/84]×22.4×1000 mL |
| B.[(b-c)/31]×22.4×1000 mL |
| C.[(c-a)/106]×22.4×1000 mL |
| D.[(c-a)/106]×2×22.4×1000 mL |
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】用葡萄糖制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(1)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:。甲同学还发现用同浓度FeCl3,Fe(NO3)3溶解银镜,FeC l3溶液溶解Ag的反应更快更完全,请解释其原因:
l3溶液溶解Ag的反应更快更完全,请解释其原因:
(2)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
| 实验步骤(不要求写具体操作过程) |
预期现象和结论 |
| ① ② …… |
若银镜消失,假设2成立。 若银镜不消失,假设2不成立。 |
【思考与交流】
(3)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO3-都氧化了Ag。
你是否同意丙同学的结论,并简述理由:。