(15分)阅读分析材料,据此完成下列要求
短周期元素A、B、C、D、E、F,它们的原子序数依次增大,其中B和C为同一周期;D、E、F为同一周期;A和D、C和F分别为同一主族;C元素原子的最外层电子数是次外层电子数的3倍;D是所在周期原子半径最大的元素(除稀有气体外);E是非金属元素,其单质在电子工业中有重要用处。
⑴A元素与碳元素按质量比1:3可以形成化合物X,将C2、X和23.4gD2C2置于密闭容器中,用电火花引起化学反应,反应结束后,容器内的气压为零(250℃),将残留物溶于水中,无气体产生,则C2与X的物质的量之比为 。根据其反应方程式分析,若反应中有4mol电子转移,则消耗C2的物质的量为 mol。
⑵工业上生产单质E的化学方程式为: ;指出E的氧化物在通讯中的一种用途 。
⑶一定条件下,A2气体与B2气体充分反应可生成6.8g空间构型三角锥形的气体,放出18.44kJ热量,则该反应的热化学方程式为为: ;A与B按原子个数比1:2可形成相对原子质量为32的化合物,写出该化合物与足量盐酸反应的离子方程式 。
⑷A2与C2在KOH的浓溶液中可以形成原电池。如果以Pt为电极,在电池的两极分别通入A2和C2,则通入的A2一极的电极反应式为: 。
⑸在10L的密闭容器中,通入2molFC2和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,C2的浓度为0.21mol/L,则平衡时FC2的转化率为 。
某烃A 0.2 mol 在氧气中完全燃烧后,生成CO2和H2O各1.2 mol。试回答:
(1)烃A的分子式为_____________。
(2)若取一定量的烃A完全燃烧后,生成CO2和H2O各3 mol,则有________g烃A参加了反应,燃烧时消耗标准状况下的氧气___________L。
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为__________________。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简简式__________________________________________。
一氯甲烷,也叫甲基氯,常温下是无色气体,密度为0.9159克/厘米3,熔点为-97.73℃,沸点为-24.2℃,18℃时在水中的溶解度为280毫升/毫升水,与乙醚、丙酮或苯互溶,能溶于乙醇。在实验室里可用下图装置制取一氯甲烷:
制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸。
试填写下列空白:
(1)制备一氯甲烷的化学方程式,
(2)装置b的作用是;
(3)已知卤代烃能发生碱性水解,转化为醇。装置e中可能发生的反应方程式为
;
(4)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃燃烧现象有明显区别)。CH3Cl燃烧的化学方程式是;
(5)实验中实际按甲醇和浓盐酸1︰2(物质量之比)进行反应的理由是;
(6)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇~浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是;
(7)实验结束后,d中收集到的液体中含有。
下列实验操作或叙述正确的是(填序号,多选倒扣分,扣完为止。)
| A.乙醇中含有少量水可加入金属钠再蒸馏制得无水乙醇 |
| B.将无水乙醇和浓硫酸按体积比3:1混合,加热至140°C制取乙烯 |
| C.蔗糖水解用稀硫酸作催化剂,加热一段时间,然后加入银氨溶液检验是否发生了水解 |
| D.在鸡蛋白溶液中加入浓HNO3,微热后会生成黄色物质 |
E.油脂在皂化反应后,反应混合物中加入食盐可将肥皂分离出来
F.植物油和裂化汽油可用溴水鉴别
现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)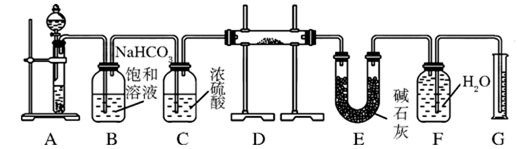
请回答下列问题:
(1) 装置A中的液体试剂选用,理由是;
(2) 装置B的作用是,装置E中碱石灰的作用是;
(3) 装置D中发生反应的化学方程式是:
、;
(4) 若开始时测得样品的质量为2.0 g,反应结束后测得生成气体的体积为224 mL(标准状况),请计算出试样中Na2O2的纯度,要求写出计算过程。
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。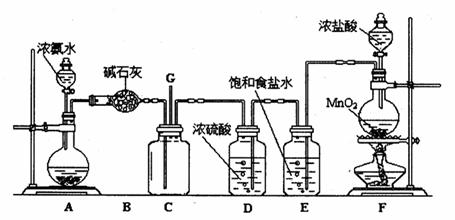
请回答下列问题:
(1) F中发生反应的化学方程式为;
(2)C中发生的反应为:8NH3 + 3Cl2=== N2 + 6NH4Cl ,其中氧化剂与还原剂的物质的量之比为;当a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数常数为mol-1(用含a、b的代数式表示);
(3) 将F制得的氯气通人含74g Ca(OH)2的石灰乳中,最多可制得漂白粉g。