三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体,无色、无臭,在潮湿空气中泄露会产生白雾、红棕色气体等现象,反应方程式为:aNF3+bNF3=c +dHNO3+eHF。下列说法正确的是
| A.反应方程式横线处物质为NO,且a=3、b=5、c=2、d=1、e=9 |
| B.反应中被氧化与被还原的原子物质的量之比为2:1 |
| C.若反应中生成0.2molHNO3,则反应共转移0.2mole- |
| D.反应中NF3是氧化剂,H2O是还原剂 |
在恒温、体积为2 L的密闭容器中进行反应:2A(g) 3B(g)+C(g),若反应物在前20 s由3 mol降为1.8 mol,则前20 s的平均反应速率为( )
3B(g)+C(g),若反应物在前20 s由3 mol降为1.8 mol,则前20 s的平均反应速率为( )
A.v(B)=0.03 mol·L-1·s-1
B.v(B)=0.045 mol·L-1·s-1
C.v(C)=0.03 mol·L-1·s-1
D.v(C)=0.06 mol·L-1·s-1
一定温度下在一容积恒定的密闭容器中,进行如下可逆反应:2A(g)+B(s) C(g)+D(g)。当下列物理量不再发生变化时,能表明该反应已达到平衡状态的是( )
C(g)+D(g)。当下列物理量不再发生变化时,能表明该反应已达到平衡状态的是( )
①容器内混合气体的密度②容器内混合气体的压强③容器内混合气体的总物质的量④容器内C物质的物质的量浓度
| A.①④ | B.②③ |
| C.②③④ | D.④ |
对于可逆反应:2SO2(g)+O2(g) 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
| A.增大压强 | B.升高温度 |
| C.使用催化剂 | D.多充O2 |
如图为1 mol甲烷在足量的氧气中燃烧生成CO2(g)和H2O(g)时的能量变化示意图,由此图分析得出的下列结论中正确的是( )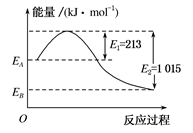
| A.甲烷燃烧为吸热反应 |
| B.甲烷的燃烧热ΔH=-802 kJ·mol-1 |
| C.EA-EB=1 015 kJ |
| D.该反应的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802 kJ·mol-1 |
某实验小组学生按照课本实验要求,用50 mL 0.5 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中放出的热量计算中和热。下列说法正确的是
| A.实验过程中没有热量损失 |
| B.图中实验装置缺少环形玻璃搅拌棒 |
| C.烧杯间填满碎泡沫塑料的作用是固定小烧杯 |
| D.酸或碱的物质的量越大,所测中和热的数值越大 |