在25℃、1.01×105Pa下,将22gCO2通入到750mL1.0mol/L的NaOH溶液中充分反应,放出xkJ热量。已知该条件下,1mol CO2通入到2L1.0mol/LNaOH溶液中充分反应,放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确为
| A.CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x)kJ/mol |
| B.CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y)kJ/mol |
| C.CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2x-y)kJ/mol |
| D.CO2(g)+NaOH(aq)=2NaHCO3(aq)△H=-(8x-2y)kJ/mol |
已知下列热化学方程式,则③中的Q3值为
Zn(s)+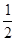 O2(g)=ZnO (s)△H=" -" Q1 kJ• mol-1①
O2(g)=ZnO (s)△H=" -" Q1 kJ• mol-1①
Hg(l) +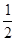 O2(g)=HgO (s)△H= -Q2 kJ• mol-1②
O2(g)=HgO (s)△H= -Q2 kJ• mol-1②
Zn(s) +HgO (s) =Hg(l)+ ZnO (s)△H= -Q3 kJ• mol-1③
| A.Q2 -Q1 | B.Q1 +Q2 | C.Q1- Q2 | D.-Q1- Q2 |
X、Y、M、Z四种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素。下列说法不正确的是
| A.化合物YZ3极易溶解于水 |
| B.Z与M可以形成含有非极性键的化合物 |
| C.12 g14X中含有中子的物质的量为8 mol |
| D.由上述四种元素组成的离子化合物受热易分解 |
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图3中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是 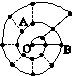
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.B元素是图中金属性最强的元素
D.A、B组成的化合物中可能含有共价键
下列表示物质结构的化学用语正确的是
| A.含7个中子的碳原子符号:12C |
B.NaCl的电子式: |
C.氯原子的结构示意图: |
D.CSO的电子式: |
柳州的龙江河铬污染事故再一次令人触目惊心,环境保护刻不容缓。下列关于铬的一种原子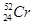 说法正确的是
说法正确的是
A.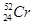 与 与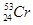 互为同素异形体 互为同素异形体 |
B.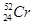 含有24个中子 含有24个中子 |
C.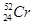 与 与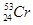 互为同位素,物理性质、化学性质均相同 互为同位素,物理性质、化学性质均相同 |
D.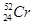 中子数比电子数多4个 中子数比电子数多4个 |