阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是( )
| A.将含有NO2和N2O4分子数共约6.02×1023个的混合气体温度降至标准状况时,其体积约为22.4L |
| B.在1 L lmol·L-1的氨水中,含有的NH3与NH3·H2O分子的总数小于6.02×1023个 |
| C.0.05mol C5H12分子中所含共价键的数目约为6.02×1023个 |
| D.l mol S和足量的铜粉反应,转移电子数目约为6.02×1023个 |
下列实验的操作、现象、结论均正确的是
| 选项 |
操作 |
结论 |
| A |
用洁净的铂金丝沾取硫酸盐在酒精灯上灼烧,焰色为黄色 |
该硫酸盐一定含Na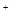 一定不含K 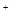 |
| B |
二氧化硫通入Ba(NO3)2溶液有白色沉淀生成,试管口出现浅红棕色气体 |
酸性条件下NO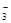 具有强氧化性 具有强氧化性 |
| C |
在淀粉的水解液中加入新制Cu(OH)2悬浊液加热,无红色沉淀 |
淀粉没有发生水解 |
| D |
某试样溶液中加入少量稀盐酸,有白色沉淀生成 |
试样中一定含有Ag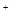 |
下列关于阿佛加德罗常数的说法正确的是
| A.1 L 0.1 mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1 NA |
| B.一定条件下的密闭容器中,6.4 g SO2可被氧气氧化得到SO3的分子数为0.1 NA |
| C.常温下18 g铝放入足量浓硫酸中转移电子数2 NA |
| D.0.1 NA的NO在一密闭容器中与足量氧气完全反应,得到0.1 mol NO2 |
下列离子方程式书写正确的是
A.将过量的CO2通入Ca(ClO)2溶液中:H2O+CO2+Ca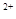 +2ClO +2ClO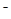 =CaCO3↓+2HClO =CaCO3↓+2HClO |
B.将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO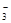 =CO =CO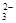 +H2O +H2O |
C.Fe3O4与稀HNO3反应:Fe3O4+8H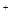 =Fe =Fe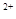 +2Fe +2Fe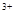 +4H2O +4H2O |
D.向NaHCO3溶液中加入少量Ca(OH)2:HCO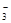 +Ca +Ca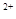 +OH +OH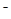 =CaCO3↓+H2O =CaCO3↓+H2O |
分类思想是学习化学的重要思想,从分类的角度分析正确的是
| A.SO2和NO2溶于水都显酸性,因而它们都是酸性氧化物 |
| B.Na2O和NH3的水溶液均能导电,故均为电解质 |
| C.Si和SiO2均属于原子晶体 |
| D.Na2O和Na2O2与水反应均会生成强碱,故都是碱性氧化物 |
水是生命之源,下列关于水的说法正确的是
| A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 |
| B.某温度下,pH=6的蒸馏水显酸性 |
| C.氯气有毒,因而自来水的杀菌消毒一定不能使用氯气 |
| D.明矾可用于水的净化与杀菌消毒 |