下列曲线图(纵坐标为沉淀的量,横坐标为加入物的量)与对应选项不正确的是( )
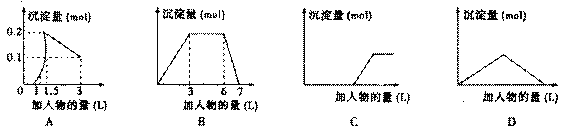
| A. | 向1L浓度均为0.1mol/L的Ba(OH) 2、NaAlO 2混合液中加入0.1 mol/L稀H 2SO 4溶液 |
| B. | 向含有0.1 mol/L AlCl 3和0.3mol/L NH 4Cl的1L混合液中加入0.1mol/LNaOH溶液 |
| C. | 向烧碱溶液中滴加明矾溶液 |
| D. | 向Ba(OH) 2溶液中逐渐通入二氧化碳 |
化学与生产、生活密切相关。下列叙述正确的是
| A.六水氯化钙可用作食品干燥剂 |
| B.生石灰作干燥剂是物理变化 |
| C.为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 |
| D.“血液透析”利用了胶体的性质 |
下列实验操作和处理方法可能会引发安全事故的是
①将水沿着烧杯内壁缓慢加入浓硫酸中,并用玻璃棒不断搅拌
②给试管中的液体加热时,试管口不朝向任何人
③夜间厨房发生煤气泄漏时,立即开灯检查煤气泄漏原因,并打开所有门窗通风
④用氢气还原氧化铜时,先加热氧化铜,再通入氢气。
| A.④ | B.①③④ | C.①④ | D.①②③④ |
成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是
| A.木已成舟 | B.铁杵成针 | C.蜡炬成灰 | D.滴水成冰 |
化学中常用图像直观地描述化学反应的进程或结果。下列对图像的描述正确的是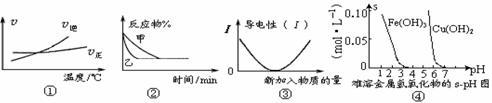
A.根据图①可判断可逆反应A2(g)+3B2(g) 2AB3(g),正反应是吸热反应 2AB3(g),正反应是吸热反应 |
B.图②表示压强对反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 |
| D.根据图④可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH在4~5之间即可 |
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图 所示),下列说法正确的是()
①a=5时,A是强酸,B是弱酸;②若A、B都是弱酸,则5>a>2;
③稀释后,A酸溶液的酸性比B酸溶液强; ④A、B两种酸溶液的物质的量浓度一定相等.
A.①② B.③④ C.①③ D.②④