(10分)工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1: ▲ 。
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为 ▲ 。
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为 ▲ ;
②若V=35,试计算混合物中CuS的质量分数。
I.2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示。请回答下列问题。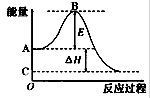
(1)图中A、C分别表示、,E的大小对该反应的反应热(填“有”或“无”)影响。
(2)已知单质硫的燃烧热为296kJ·mol-1,S(s)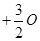 2(g)
2(g)SO3(g)△H=—395kJ·mol-1,则图中△H=kJ·mol-1。
II.某温度时,在2L密闭容器中用O2和SO2合成SO3,它们的物质的量随时间的变化如图甲所示。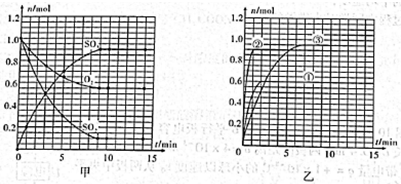
(1)列式并计算该反应在0—3min内产物SO3的平均反应速率。
(2)该反应达到平衡时反应物SO2的转化率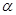 等于。
等于。
(3)计算在该温度下反应的平衡常数K=。(保留小数点后一位数字)
(4)已知,合成SO3是放热反应。图乙所示是改变实验条件后(温度、压强、催化剂)得到的SO3物质的量随时间变化的曲线,则典线①、②、③所对应的实验条件改变分别是:①,②,③。
)已知,A是常见的金属单质,与B的水溶液反应生成C和D。D、F是气体单质,D在F中燃烧时产生苍白色火焰。A、B、C、D、E、F六种物质的相互转化关系如图11所示(反应条件及部分产物未列出)
(1)写出下列物质化学试:AC。
(2)A所对应的元素在周期表中的位置是;反应②(在水溶液中进行)的离子方程式为。
(3)E溶液中各离子浓度,由大到小的顺序为。
(4)若要将E的溶液进行蒸发结晶得到E的无水晶体,需向其中不断补充,其目的是。
(5)向0.10mol·L-1E溶液中加入氢氧化钠稀溶液充分搅拌有沉淀生成,当溶液的pH=5时,溶液中金属离子浓度=mol·L—1(已知该沉淀Ksp=4.0×10-38)。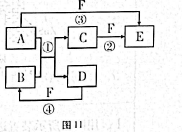
.已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
| 经过时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
30 |
120 |
280 |
350 |
370 |
(1)①反应速率最大的(即0~1 min、1~2 min、2~3 min、3~4 min、4~5 min)时间段为 ,原因是 。
②反应速率最小的时间段为 ,原因是。
以甲醇、空气和氢氧化钾溶液为原料,金属铂为电极可构成普通的燃料电池。该电池的负极上的电极反应式为____________
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时到达平衡,依图所示:
①该反应的化学方程式是 。
②反应起始至t,Y的平均反应速率是。