纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干,焙烧除去水分得到粉体TiO2。
用现代分析仪器测定TiO2粒子的大小,用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_____________ ___ ________________。
(2)检验TiO2·xH2O中Cl-是否被除净的方法是________________ ________________。
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________ _______;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_____ ___(填字母代号)。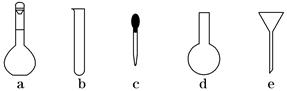
(4)滴定终点的现象是______________________________________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为________________.
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”).
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果________。
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。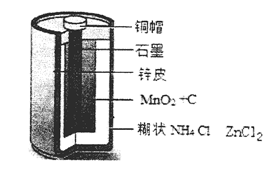
(1)该电池的负极材料是 电池工作时,电子从Zn极流向 填(“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。
欲除去Cu2+,最好选用下列试剂中的 (填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液制取,则MnO2在 极产生。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 g。(MnO2的摩尔质量为:87g/mol)
回答下列问题。
(1)如右图,某温度(t℃)时水的图像如下,a点离子积KW=__________mol2·L-2;该温度下,pH=12的NaOH与pH=2的H2SO4等体积混合,溶液显_________性。
(2)25℃时,向0.1mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH__________,NH+4的物质的量浓度________。(填增大、减小或不变)
(3)体积相等的稀NaOH和CH3COOH溶液混合,若溶液中c(Na+)=c(CH3COO-),则该溶液显______(填“酸性”、“碱性”、“中性”),则混合前c(NaOH)___________C(CH3COOH)(填“>”、“<”或“=”)。
(4)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全(残留在溶液中的c(Fe3+)<10-5mol·L-1),则溶液的pH最小为___________。
(5)用可溶性碳酸盐,可以浸取CaSO4固体,则溶液浸取过程中会发生反应:
CaSO4(s)+CO2-3(aq)  CaCO3(s)+SO2-4(aq)。
CaCO3(s)+SO2-4(aq)。
已知298K时,KSP(CaCO3)=2.80×10-9, KSP(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为_________(计算结果保留三位有效数字)。
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数这比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是_________、_________;杂化轨道分别是__________、_________;a分子的立体结构是___________。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是________晶体,_________晶体。
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)__________。
(4)Y与Z比较,电负性较大的_________,
(5)W元素的化学式__________,其+2价离子的核外电子排布式是___________。
某消毒液的主要成分为 NaClO(混有少量NaCl),请用相应的化学用语来解释下列事实。
(1)该消毒液可用NaOH 溶液吸收Cl2 制备,化学方程式为_______________________。
(2)该消毒液的pH 约为12,离子方程式为__________________________。
(3)向FeSO4 溶液中滴入少量该溶液,溶液颜色变成棕黄色,反应的离子方程式为______________。
(4)该消毒液不能与洁厕灵(主要成分为浓盐酸)混用,否则会产生中毒危险。每产生1 mol Cl2(标准状况下),转移电子个数约为________________ 。
有以下六种元素:A是宇宙中最轻的元素。D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3P轨道后,3P轨道呈全充满状态。G原子2P轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数差8.
L位于周期表第四周期、第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如图所示,
请回答下列问题:
(1)E元素的电负性____________(填“>”“<”或“=”)M元素的电负性。
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能____________(填“大”或“小”)。
(3)M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是__________,M2E2是___________(填“极性”或“非极性”)分子。
(4)L的外围电子排布式为____________,该元素位于周期表中的____________族。
(5)R的化学式为________________(用元素符号表示),属于____________晶体。
已知R晶体的密度为ρ g.cm-3,则该晶胞的边长a____________cm。(阿常数用NA表示)