肉桂醛在食品、医药化工等方面都有应用。
(1)质谱分析肉桂醛分子的相对分子质量为132。其分子中碳元素的质量分数为81.8%,其余为氢和氧。分子中的碳原子数等于氢、氧原子数之和。肉桂醛的分子式是____________。
(2)肉桂醛具有下列性质:
请回答:
①肉桂醛是苯的一取代物,苯环侧链上有三种不同化学环境的氢原子,其结构简式是 _______________________ 。
②Z不能发生的反应类型是 。
| A.取代反应 | B.消去反应 | C.加成反应 | D.加聚反应 |
③Y与乙醇在一定条件下作用得到肉桂酸乙酯,该反应的化学方程式是_____________。
④Y的同分异构体中,属于酯类且苯环上只有一个取代基的同分异构体有___________种,其中任意一种的结构简式是_______________________ 。
(3)已知
Ⅰ、醛与醛能发生反应,原理如下:
Ⅱ、合成 -甲基肉桂醛(C10H10O)的工业流程如下图所示(甲为烯烃):
-甲基肉桂醛(C10H10O)的工业流程如下图所示(甲为烯烃):
请回答:
①写出丙和丁生成 -甲基肉桂醛的化学方程式是______________________________。
-甲基肉桂醛的化学方程式是______________________________。
②醛和酯也可以发生如(3)Ⅰ类似的反应。食用香料肉桂酸乙酯可通过如下反应合成:
戊的结构简式是_______________________________________ 。
设反应①Fe(s)+CO2(g) FeO(s)+CO(g)△H=Q1的平衡常数为K1,
FeO(s)+CO(g)△H=Q1的平衡常数为K1,
反应②Fe(s)+H2O(g) FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
| 温度(T) |
K1 |
K2 |
| 973 |
1.47 |
2.38 |
| 1173 |
2.15 |
1.67 |
(1)从上表可推断,反应①是________(填“放”或“吸”)热反应;
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g)△H=Q3
CO(g)+H2O(g)△H=Q3
①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
A.缩小容器体积 B.降低温度 C.使用合适的催化剂
D.设法减少CO的量E.升高温度
②根据反应①与②推导出Q1、Q2、Q3的关系式Q3=_____________;
已知反应A(g)+B(g) C(g)+D(g)△H<0回答下列问题:
C(g)+D(g)△H<0回答下列问题:
(1)该反应是________反应(填“吸热”或“放热”)
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”“减小”或“不变”)。原因是________________________________________。
(3)反应体系中加入催化剂,对反应热是否有影响?________;原因是_________________________________________________。
(4)反应体系中加入催化剂,反应速率________(填“增大”“减小”或“不变”);反应的活化能________(填“增大”“减小”或“不变”)。
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=―24.8kJ•mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=―47.2kJ•mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:__________________________________________________
下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: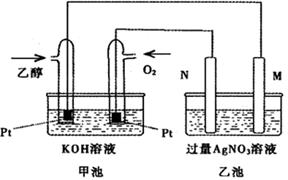
(1)M电极的材料是,电极名称是,加入乙醇的铂电极的电极反应
式为。写出乙池中发生的化学反应的离子方程式:。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为。
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量。表示该反应的热化学方程式为。
(4)甲烷也是一种很好的清洁能源。蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ/mol。356g“可燃冰”(若分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水.放出的热量为kJ。
将下列物质进行分类:
①11H与13H;②O2与O3;③乙醇与甲醚(CH3-O-CH3);④H2O与D2O;⑤CH3CH2CH2CH3与CH3-CH(CH3)-CH3;⑥C60与C70;⑦CH4与C4H10
(1)互为同位素的是 (填编号,下同);互为同素异形体的是
互为同分异构体的是互为同系物的是
(2)有下列反应:①由乙烯制乙醇;②甲烷在空气中燃烧;③由乙烯制氯乙烷;④丙烯使溴水褪色;⑤苯与浓硝酸、浓硫酸的混合酸反应;⑥用丙烯制聚丙烯;其中属于取代反应的是(填序号,下同),属于氧化反应的是,属于加成反应的是,属于加聚反应的是。
(3)①正丁烷;②异丁烷;③正戊烷;④异戊烷;⑤新戊烷;⑥丙烷,物质的沸点由高到低的排列顺序是:
(4)某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.移取20 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 cm 处; |
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)__________________________________。