根据右图回答,下列说法不正确的是: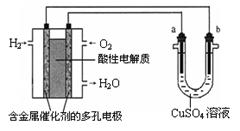
| A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 |
| B.燃料电池中正极反应为O2+4e-+4H+=2H2O |
| C.若a为粗铜,b为纯铜,该装置可用于粗铜的精炼 |
| D.电子经导线流入a电极 |
某元素的一价阴离子,核外有10个电子,质量数为19,则中子数为
| A.9 | B.10 | C.11 | D.12 |
向NaAlO2溶液中持续通入一种气体,开始时产生沉淀,随后沉淀又逐渐溶解,该气体是
| A.NO2 | B.CO2 | C.NH3 | D.CO |
标准状况下,在一活塞式的密闭容器中,充入2.24L的NO,再小心充入1.12LO2,反应完毕,仍恢复至标准状况,则下列叙述正确的是
| A.气体体积仍为2.24L | B.气体体积应小于2.24L |
| C.气体体积应大于2.24L | D.该气体在标准状况下的密度为2.05g/L |
下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是
| A.Na+、H+、CO32-、Cl- | B.H+、Fe2+、Cl-、NO3- |
| C.Na+、Al3+、OH-、Cl- | D.NH4+、H+、OH-、NO3- |
下列各组物质间的反应与反应类型不相符的是()
| A.乙烯与溴水(加成反应) | B.甲苯与浓硝酸(硝化反应) |
| C.氯乙烷与氢氧化钠醇溶液 (取代反应) | D.乙烯与高锰酸钾(氧化反应) |