【化学——选修:物质结构与性质】( 15分)
原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满。下表是主要化合价及原子半径数据:
| |
A |
B |
C |
D |
E |
F |
| 主要化合价 |
-1 |
-3 +5 |
-2 +6 |
-1 +7 |
+2 |
+1 +2 |
| 原子半径nm |
0.071 |
0.11 |
0.102 |
0.099 |
0.197 |
0.117 |
请回答下列问题:
(1)B、C、D三种元素第一电离能数值由小到大的顺序是 (填元素符号);
(2)B的氢化物中心原子采取 杂化,空间构型是 形,是 分子
(填“极性”或“非极性”);
(3)F2+与NH3 形成配离子的化学式为 ,F单质晶体晶胞是下图的
(填①、②、③或④);
(4)A 、E两种元素形成晶体晶胞是下图中的 (填①、②、③或④),A离子的配位数是 ;
(5)右图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,
请选出C的氢化物所在的折线 (填n、m、x或y)。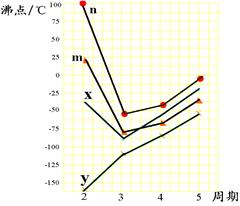
A、B、C三种强电解质,它们在水中电离出的离子如右表所示:
右图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接 通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如右下图。据此回答下列问题:
通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如右下图。据此回答下列问题: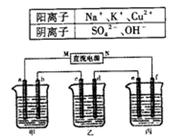
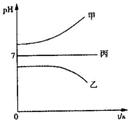
(1)M为电源的极(填写“正”或“负”)电极b上发生的电极反应为; (2)计算电极e上生成的气体在标准状态下的体积:;
(2)计算电极e上生成的气体在标准状态下的体积:;
(3)写出乙烧杯的电解池反应;
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?;
(5)若经过一段时间后,测得乙中c电极质量增加了16 g,要使丙恢复到原来状态的操作。
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液。如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32一(aq)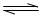 BaCO
BaCO 3(s)+SO42-(aq)(平衡常数K=0.042)
3(s)+SO42-(aq)(平衡常数K=0.042)
(1)现有0.20 mol BaSO4,每次用1.00 L 2.0 mol·L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理次。
(2)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是。
甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) CH3OH(g)△H1
CH3OH(g)△H1
反应II:CO2(g)+3H2(g);==CH3OH(g)+H2O(g)△H2
(1)上述反应“ 原子经济性”较高的是(填“Ⅰ”或“Ⅱ”)。
原子经济性”较高的是(填“Ⅰ”或“Ⅱ”)。
(2)右表所列数据是反应I在不同温度下的化学平衡
常数(K)。由表中数据判断△H10(填“>”、
“=”或“<”)。
| 温度 |
25℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)="0.2" mol·L-1,则CO的转化率为,此时的温度为(从上表中选择)。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连。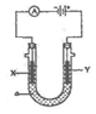
(1)若X是锌,Y是碳棒电极,a是饱和NaCI溶液,则①该原理可制得化工原料有;②Y极的电极反应式为
(2)若要用电解方法精炼粗铜,则①电解液a选用;②Y电极反应式是。(说明:杂质发生的电极反应不必写出)
(3)若要在某铁制小饰品上镀上一层银,则①Y电极的材料是;②X电极反应式是。
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)。
| A.9 | B.13 | C.11~13之间 | D.9~11之间 |
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中c(Na+)
c(CH3COO-)(填“>”、“=”或“<”)。
(3)常温下,已知某NH4Cl溶液中的c(NH4+)=c(Cl一),则该溶液的pH7(填“>”、“=”或“<”)。
(4)如果将HCl和CH3COONa溶液等浓度、等体积混合,则混合溶液中各离子浓度的大小关系为