下图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有: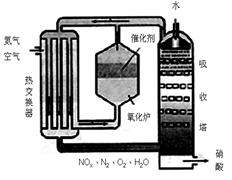
①4NH3(g)+5O2(g) 4NO(g)+6H2O(l) △H<0
4NO(g)+6H2O(l) △H<0
②2NO(g)+O2(g) 2NO2(g) △H<0
2NO2(g) △H<0
③3NO2(g)+H2O(l) 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0
(1)能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 。
| A.适当升高温度 | B.适当增大吸收塔内的压强 |
| C.增大空气中O2的浓度 | D.吸收塔内填充瓷环,增大气液接触面 |
(2)在2L密闭容器内充入0.50 mol NO和0.25 mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数K= 。
(3)某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/cm3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是 。
②每小时从吸收塔淋下的水的质量应是多少吨?
(1)2012年伦敦奥运会火炬采用丙烷为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题: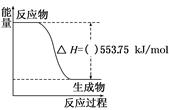
①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为________。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol C2H5OH(g)=C2H5OH(l) ΔH=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3 kJ/mol
若使46 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为________kJ。
②碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应: C(s)+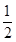 O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: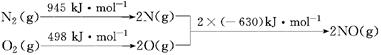
写出该反应的热化学方程式:________________。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(ⅰ)CO(g)+2H2(g)=CH3OH(g)ΔH1=-90.1 kJ·mol-1
(ⅱ)CO2(g)+3H2(g)=CH3OH(g)+H2O(g)ΔH2=-49.0 kJ·mol-1
水煤气变换反应:
(ⅲ)CO(g)+H2O(g)=CO2(g)+H2(g)ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:
(ⅳ)2CH3OH(g)=CH3OCH3(g)+H2O(g)ΔH4=-24.5 kJ·mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为_______________。
根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响_________________。
有关元素X、Y、Z、D、E的信息如下:
| 有关信息 |
|
| X |
元素主要化合价为-2,原子半径为0.074 nm |
| Y |
所在主族序数与所在周期序数之差为4 |
| Z |
原子半径为0.102 nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D |
最高价氧化物对应的水化物可溶于水,且能电离出电子数相等的阴、阳离子 |
| E |
单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为___________。
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)_______。
①保存EY2溶液时,需向溶液中加入少量E单质
②EY2只能通过置换反应生成,EY3只能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
(3)将Z单质在X的单质中燃烧的产物和等物质的量的Y单质同时通入足量的水中,充分反应后的溶液中滴入品红溶液,现象是__________________,有关反应的离子方程式为________________________________________________________________________。
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)________。
(2)由以上某些元素组成的化合物A、B、C、D有如下转化关系:
A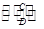 B(在水溶液中进行)
B(在水溶液中进行)
其中C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式________;D的电子式________。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为____________;由A转化为B的离子方程式为_____________________________________________。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:________________________________________。A、B浓度均为0.1 mol·L-1的混合溶液中,离子浓度由大到小的顺序是__________________;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有_______________________________。
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置__________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)______。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________________________________________________________________________。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:________________________________________________________________________。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______________________________________________________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式______________________________________________________________________。