(14分)下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)从氯化钾溶液中得到氯化钾固体,选择装置 (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置 。
(2)从碘水中分离出I2,选择装置 ,该分离方法的名称为 。
(3)装置A中①的名称是 ,进水的方向是从 口进水。装置B在分液时为使液体顺利下滴,应进行的具体操作是 。
现有HA、HB、HC三种一元弱酸,分析并回答下列问题:
①等PH值的三种酸,加水稀释的PH值变化如图比较三种酸的酸性强弱〉
〉三种酸的物质的量浓度由大到小的顺序。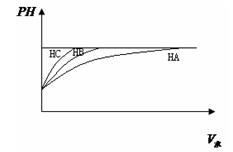
②同浓度的NaA, NaB, NaC,PH值的大小〉〉。
③25℃时若已知NH4B的溶液显中性,则NH4A溶液的PH值7,写出NH4C的水解的离子方程式。
④PH=2的HA与PH=12的NaOH等体积混合后,溶液中离子浓度由大到小的顺序是。
在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g) 3C(g)+D(s),已知将2molA和1molB充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中的体积分数为n%。
3C(g)+D(s),已知将2molA和1molB充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中的体积分数为n%。
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是(选填序号)。
A. 体系压强不再变化 B. v正(A)=2v逆(B)
C. 体系的密度不再变化 D. 混合气体的平均相对分子质量不再变化
(2)如果用下列情况的配比作起始物,在同样的容器和温度下达到平衡,其结果一定是:
C的物质的量为2Wmol,C在平衡混合气体中的体积分数仍为n%的是
A. 4molA+2molB B. 6molC+1molD
C. 1molA+0.5molB+1.5molC+0.5molD D. 2molA+1molB+3molC+1molD
E. 2molA+1molB+3molC+2molD (4)若维持该题条件不变,
(4)若维持该题条件不变, 仅从生成物开始配比,要求达到平衡时,C的物质的量仍为Wmol,则D的起始物质的量n(D)应满足的条件是(用含W的代数式表示
仅从生成物开始配比,要求达到平衡时,C的物质的量仍为Wmol,则D的起始物质的量n(D)应满足的条件是(用含W的代数式表示 )
)
(5)此反应的v—t图象如甲图,若其他条件都不变,只是在反应前加入合适的催化剂,则
其v—t图象如乙图,请用“=、<、>”填空: a1a2;两图中阴影部分面积:甲乙。
某无色溶液,其中可能存在如下离子:Na+、Ag+、Ba2+、Al3+、AlO2―、S2―、CO32―、SO32―、SO42―,现取该溶液进行有关实验,结果与下图所示。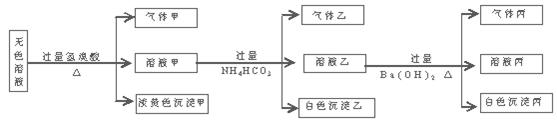
试回答下列问题:
(1)生成沉淀甲的离子方程式为
(2)由溶液甲生成沉淀乙的离子方程式
(3)沉淀丙可能是;
如何用一化学实验来确定其成分
(4)综合上述信息,可以肯定存在的离子有
一定不存在的离子是
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g) 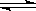 2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡移动(填“向左”“向右”或“不”);使用催化剂反应的△H(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡移动(填“向左”“向右”或“不”);使用催化剂反应的△H(填“增大” “减小” 或“不改变”)。
(2)已知:O2 (g)=O2+(g)+e-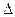 H1=" 1175.7" kJ·mol-1
H1=" 1175.7" kJ·mol-1
PtF6(g)+ e-==PtF6-(g)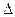 H2=" —771.1" kJ·mol-1
H2=" —771.1" kJ·mol-1
O2+PtF6-(S)=O2+ (g)+ PtF6-(g)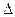 H3=" 482.2" kJ·mol-1
H3=" 482.2" kJ·mol-1
则反应O2(g)+ PtF6(g)= O2+PtF6-(S)的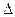 H=kJ·mol-1。
H=kJ·mol-1。
(3)在25℃下,向浓度均 为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显性(填“酸”“碱”或“中”);用含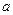 的代数式表示NH3·H2O的电离常数Kb=。
的代数式表示NH3·H2O的电离常数Kb=。
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各小题:
(1)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=。
(用上图中出现的字母表示)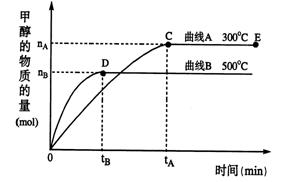
(2)在其他条件 不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是。
不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是。
a.氢气的浓度减小 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(3)据研究,反应过程中起催化作用的为C u2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:(用化学方程式表示)。
u2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:(用化学方程式表示)。
(4)能源问题是人类社会面临的重大课题,甲醇是未来的重要的能源物质。常温下,1g甲醇完全燃烧生成液态水时放出22. 7kJ的能量,写出甲醇燃烧热的热化学方程式。