甲、乙、丙、丁是由前20号元素组成的物质,它们之间存在如下转化关系。
甲+乙 → 丙+丁
(1)转化关系中所涉及的反应为非氧化还原反应,且乙为水。若甲为块状固体,丙为可燃性气体,其分子内既含有极性键又含有非极性键。则丙的电子式是 。
(2)转化关系中所涉及的反应为氧化还原反应,且乙为水。
① 若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,此反应的离子方程式是 。
② 若丙和丁都可在一定条件下还原CuO,此反应的化学方程式是 。
③ 若甲是由N和O元素组成的气态物质,呈红棕色。将3.36 g Fe加到一定量丙溶液中,收集到1.12 L气体丁(已折算为标准状况),则反应的离子方程式是:
。
(3)若甲+乙 → 丙+丁仅表示置换反应,其中:甲丁为单质乙丙为化合物请写出满足以下要求的3个置换反应的化学方程式:① 所涉及的元素的原子序数小于20 ② 6种单质分属6个不同的主族
① ② ③
下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的离子反应方程式为: 。装置B中饱和食盐水的作用是 ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入 。
| a |
b |
c |
d |
|
| Ⅰ |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| Ⅲ |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为 色,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 。
某同学设计如下实验方案,以分离NaCl和CaCl2两种固体混合物,试回答:
(1)操作I的名称是 ,操作II的名称是 。图中括号内的操作步骤均为 ;
(2)写出生成B的方程式为: 。
(3)按此实验方案得到的NaCl固体中肯定含有 (填化学式)杂质;为了解决这个问题可以向操作(II)得到的液体A中加入适量的 ;反应的方程式为:__________________;
某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO 1 000 mL、密度1.19 g·cm-3。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为 mol·L-1(保留两位有效数字)。
(2)某实验需用480 mL含25%NaClO的消毒液。该同学参阅该“84消毒液”的配方,欲用NaClO固体配制该消毒液。
①下列说法正确的是 。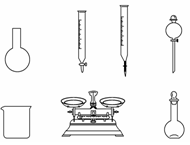
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用久置的NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
②在配制过程中,下列操作可能使配制的溶液的浓度偏大的是 。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
下图表示配制 100 mL 0.100 mol·L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题: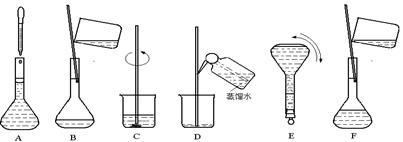
(1)步骤E中将某玻璃仪器上下颠倒数次,该仪器的名称是 。
(2)步骤B通常称为转移,步骤A通常称为 。
(3)将上述实验步骤A→F按实验过程先后次序排列 。
聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m, 广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
验证固体W焙烧后产生的气体含有SO2的方法是:
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→____→____→____→____→f。装置A中发生反应的化学方程式为_________________。
(3)制备绿矾时,向溶液X中加入过量__________,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有_______________
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数______(填“偏大”、“偏小”或“无影响”)。