下列离子方程式正确的是
A.偏铝酸钠溶液显碱性的原因:AlO2-+2H2O Al(OH)3↓+OH- Al(OH)3↓+OH- |
|
| B.过量的CO2通人Ca(ClO)2溶液中:CO2+ClO-+H2O=HCO3-+HClO | |
C.在银氨溶液中滴加过 量稀硝酸:[Ag(NH3)2]++2H+ ="=" Ag++2NH4+ 量稀硝酸:[Ag(NH3)2]++2H+ ="=" Ag++2NH4+ |
D.水杨酸( )与过量的Na2CO3溶液混合: |
 |
|||
 |
|||
|
|

下列物质能与银氨溶液反应的是()
| A.葡萄糖 | B.油脂 | C.乙醇 | D.纤维素 |
保护环境是每一个公民的责任,下列做法:①推广使用无磷洗涤剂;②城市生活垃圾分类处理;③推广使用一次性木质筷子;④推广使用清洁能源;⑤过量使用化肥、农药;⑥推广使用无氟冰箱。其中有利于保护环境的是()
| A.①②④⑤ | B.②③④⑥ | C.①②④⑥ | D.③④⑤⑥ |
下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是( )
A.淀粉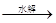 葡萄糖 葡萄糖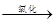 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
B.维生素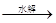 葡萄糖 葡萄糖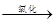 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
C.油脂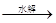 甘油和高级脂肪酸 甘油和高级脂肪酸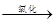 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
D.蛋白质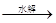 氨基酸 氨基酸 人体所需的蛋白质(人体生长发育) 人体所需的蛋白质(人体生长发育) |
为减少新鲜蔬菜中的维生素C的流失,下列有关烹调蔬菜的方法不妥当的是( )
| A.蔬菜最好洗干净后再切 |
| B.炒蔬菜的时间不能太长,炒熟即可 |
| C.新鲜蔬菜应放在冰箱中储存 |
| D.把蔬菜放在高压锅中焖煮 |
下列关于煤、石油、天然气等资源的说法正确的是( )
| A.石油裂解得到的汽油是纯净物 |
| B.石油产品都可用于聚合反应 |
| C.天然气是一种清洁的化石燃料 |
| D.水煤气是通过煤的液化得到的气体燃料 |