避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为: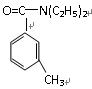
已知:RCOOH RCOCl(酰氯);RCOCl + NH3→RCONH2 + HCl,
RCOCl(酰氯);RCOCl + NH3→RCONH2 + HCl,
避蚊胺在一定条件下,可通过下面的合成路线I来合成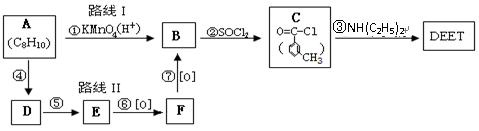
根据以上信息回答下列问题:
(1)由避蚊胺的结构简式推测,下列叙述正确的是 。
| A.它能使酸性高锰酸钾溶液褪色 | B.它能发生酯化反应 |
| C.它与甲苯互为同系物 | D.一定条件下,它可与H2发生加成反应 |
(2)在反应①~⑦中,属于取代反应的有 (填序号)。
(3)写出下列化学反应方程式:
C→DEET  ;
;
E→F 。
(4)经测定E的同分异构体能与FeCl3溶液发生显色的反应,且结构中不含乙基,试写出符合其条件的任意2个可能的结构简式 。
(5)经核磁共振氢谱图显示A的某种同分异构体J只有两个吸收峰(及两种环境的氢原子),试写出J的化学名称 ;J物质被酸性高锰酸钾氧化后得到的产物在一定条件下可与乙二醇反应,制成涤纶(聚酯纤维),试写出生产涤纶的化学方程式 。
(1)写出 CO与氧化铜反应的化学方程式并标明电子转移的方向和数目
(2)2.8gCO的物质的量为mol,含有个原子,完全与氧化铜反应时失去电子mol。
)下面是用98%的浓H2SO4(ρ="1.84" g/cm3)配制成0.5 mol/L的稀H2SO4 500 mL的操作,请按要求填空:
(1)浓硫酸的物质的量浓度为。
(2)所需浓H2SO4的体积为。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100 mL水的里,并不断搅拌。
(4)冷却后,将上述溶液转移到中,用蒸馏水洗涤烧杯2~3次,并将洗涤液注入容量瓶中。
(5)加水至距刻度处,改用加水,使溶液的凹液面正好跟刻度相平,摇匀。
)写出下列反应的离子方程式:
(1)氢氧化钠与硫酸反应;
(2)实验室制取CO2气体;
(3)少量CO2气体通入澄清石灰水;
(4)硫酸铜溶液与氢氧化钠反应。
某溶液中含有SO42-、CO32-、Cl-三种阴离子。如果每次只检验一种离子,要↑
(1)先检验,加入试剂(或溶液),反应的离子方程式为;
(2)然后检验,加入试剂(或溶液),反应的离子方程式为;
(3)最后检验,加入试剂(或溶液),反应的离子方程式为。
下图是依各个原子的性质和原子序数(1~20)画的关系图,各图的纵轴可能代表下列的某一性质:质量数、质子数、最高正价、原子半径相对大小、得电子相对能力。图2中原子序数8、9和图3中原子序数2、10、18在纵轴上没有对应的数值。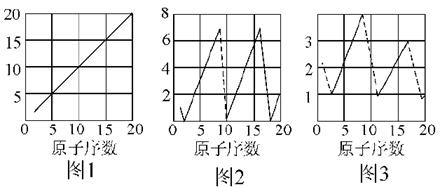
(1)图1~图3的纵轴分别代表__________、__________、__________;
(2)已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中。B是生命体的构架元素,E是同周期中半径最小的元素,G的最外层电子数比次外层电子数少2个。它们的原子序数存在如下关系:①a+b=c,②(b+d)/2=c,③(c+e)/2=d,请根据提供的信息,回答下列问题:
①下图是元素周期表前三周期的边界,请将A~G六种具体元素符号填在表中相应的位置;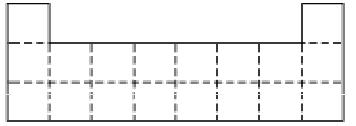
②写出铜与C元素最高价氧化物对应水化物的浓溶液反应的化学 方程_______________;
③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:
X+Y―→Z+W。若X为单质,Y、Z、W均为化合物,且该反应是重要的工业生产反应,其相应的化学方程式为__________________________。