高铁酸钾(K2FeO4)和二氧化氯(ClO2)都是高效水处理剂,其工业制备的反应原理分别为 2Fe(OH)3+3 KClO+4KOH=2K2FeO4+3KCl+5H2O
2KClO3+ Na2SO3 +H2SO4=2ClO2 + Na2SO4+ K2SO4+ H2O
下列说法中,正确的是( )
| A.上述两个反应中, KClO3做氧化剂,KClO 做还原剂 |
| B.ClO2做水处理剂原理和明矾相同 |
| C.K2FeO4用于杀菌后其还原产物还可用作净水剂 |
| D.制备等物质的量的K2FeO4和ClO2,转移的电子数之比为1 : 1 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+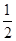 O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
| A.CH3OH的燃烧热为-192.9 kJ·mol-1 |
B.反应①中的能量变化如图所示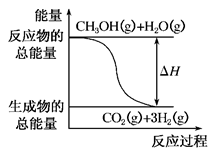 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.由②推知反应CH3OH(l)+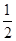 O2(g)===CO2(g)+2H2(g)ΔH >-192.9 kJ·mol-1 O2(g)===CO2(g)+2H2(g)ΔH >-192.9 kJ·mol-1 |
下列说法中正确的说法有几个 ( )
①活化分子间的碰撞一定能发生化学反应 ②普通分子间的碰撞有时也能发生化学反应 ③增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 ④有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 ⑤化学反应的实质是旧化学键断裂和新化学键形成的过程 ⑥催化剂能增大活化分子百分数,从而成千成万倍地增大化学反应速率
| A.1个 | B.2个 | C.3个 | D.4个 |
根据碘与氢气反应的热化学方程式:
①I2(g)+H2(g) 2HI(g) ΔH="-9.48" kJ·mol-1
2HI(g) ΔH="-9.48" kJ·mol-1
②I2(s)+H2(g) 2HI(g) ΔH="+26.48" kJ·mol-1
2HI(g) ΔH="+26.48" kJ·mol-1
下列判断中正确的是()
| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应①的产物比反应②的产物稳定 |
| D.物质的量相同时,反应②的反应物总能量比反应①的反应物总能量低 |
反应C(s)+H2O(g) CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是()
CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是()
| A.加入少量的C(s)粉 | B.将C(s)粉碎成细小粉末 |
| C.体积可变,充入氩气 | D.保持体积不变,充入氢气 |
下列说法中正确的是( )
| A.在100 ℃、101 kPa条件下,1 mol液态水汽化时需要吸收40.69 kJ的热量,则H2O(g) ===H2O(l)的ΔH=+40.69 kJ·mol-1 |
| B.已知CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,则CH4的燃烧热ΔH=-890.3 kJ |
C.H2(g)+Br2(g)==="2HBr(g)" ΔH=-72 kJ·mol-1其他相关数据如下表: 则表中a为230 |
| D.已知S(g)+O2(g)===SO2(s)ΔH1,S(g)+O2(g)===SO2(g)ΔH2,则ΔH2<ΔH1 |