硫酸亚铁铵(NH4)2SO4?FeSO4?6H2O是一种重要化学试剂。某探究性学习小组用除去锌镀层的铁片来制取硫酸亚铁铵,设计流程如下: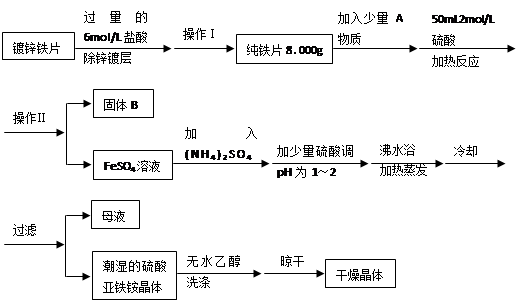
请回答下列问题:
(1)确定锌镀层被除去的标志是 ;
计算上述铁片锌镀层的厚度,不需要的数据是 (填编号)。
a.锌的密度ρ(g/cm3) b.镀锌铁片质量m 1(g) c.纯铁片质量m 2(g)
d.镀锌铁片面积S(cm2) e.镀锌铁片厚度h(cm)
锌镀层的厚度为 cm(用含ρ、m 1、m 2…等的代数式表示)。
(2)上述流程中:操作Ⅰ是取出铁片、 、 、称量;操作Ⅱ是 。
(3)A物质可以为 (填编号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
加入少量A物质的目的是 ,B物质的成分为 。
(4)加少量硫酸调节pH为 1~2的目的是 。
(5)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是 。
(6)鉴定所得晶体中含有Fe2+、NH4+、SO42―离子的实验方法正确的是 (填编号)。
a.取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象
b.取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象
c.取少量样品于试管,加水溶解,加入稀NaOH溶液,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液,观察现象
某同学应用如下所示装置研究物质的性质。其中气体A的主要成分是氯气,还含有少量空气和水蒸气。请回答下列问题:

(1)浓硫酸的作用是_______________。
(2)B中观察到的实验现象是____________________。
(3)从物质性质方面来看,这样的实验设计还存在事故隐患,应如何处理,请画出装置图(填在上图内),用化学方程式表达原理_________________________________________
在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
①生成的黑色(单质)物质是(填化学式)。
②这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是___________(填化学式),这种黑色物质继续与浓硫酸作用,产生两种气体的化学方程式为
③根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填序号)。
| A.酸性 | B.吸水性 | C.脱水性 | D.强氧化性 |
④将实验②产生的刺激性气味气体通入氯水中,可以看到氯水_________ ,说明这种气体具有_____________________性;请写出该反应的化学方程式
(12分) Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程为:。为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液 与用不含O2的蒸馏水配制的NaOH溶液反应制备。
与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入。(2)除去蒸馏水中溶解的O2常采用的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是。
(4)检验Fe3+存在的最佳试剂是,现象是 。
(5)写出Fe与H20在一定条件下反应的化学方程式 。
。
(6分 )实验需要0.1mol/LNaOH溶液450mL,根据溶液配制中情况回答下列问题:
)实验需要0.1mol/LNaOH溶液450mL,根据溶液配制中情况回答下列问题:
⑴实验中不需要的仪器有:
A. 托盘天平 B. 烧杯 C. 500 mL容量瓶 D.玻璃棒 E.滴管 F.铁架台 G.烧瓶
⑵配置该溶液需称量NaOH的质量 ___g
⑶下列操作对所配浓度偏大的有(填写 字母)
字母)
A、称量时用了生锈的砝码;
B、将NaOH放在纸张上称量;
C、NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D、往容量瓶转移时,有少量液体溅出
E、未洗涤溶解NaOH的烧杯
F、定容时仰视刻度 线
线
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
⑴ TiCl4水解生成TiO2·x H2O的化学方程式为__________________________。
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是____________;
使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。
(3)滴定终点的现象是____________________________________________。
(4)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为______________________。
(5)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果_________________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_____。