(I)多项选择题
CH3+、CH3-、CH3-都是重要的有机反应中间体,有关它们的说法正确的是 。
| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们互为等电子体,碳原子均采取sp2杂化 |
| C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
| D.CH3+中的碳原子采取sp2杂化,所有原子均共面 |
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(II)
锌是一种重要的金属,锌及其化合物有着广泛的应用。
(1)指出锌在周期表中的位置: 周期, 族, 区。
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式 ;葡萄糖分子中碳原子杂化方式有 。
(3)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于 (填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键。

(4)右上图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 。
a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2∶3,b的最外层电子数比e的最外层电子数少1;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1)e的元素符号是________。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)________________________;b的氢化物和b的最高价氧化物对应的水化物反应生成Z,则Z的化学式为________,d、e形成化合物的电子式为________________。
(3)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为________________。
有A、B、C三种元素,已知①4 g A元素的单质与水作用,在标准状况下放出氢气2.24 L,反应中有1.204×1023个电子发生转移;②B元素可与A元素形成AB2型的离子化合物,且知A、B的离子具有相同的核外电子排布;③元素C的气态氢化物可以与其最高价氧化物对应的水化物发生非氧化还原反应生成盐,1 mol该盐含有42 mol电子。
根据以上信息填写下列空白:
(1)元素符号:A:________,B:________,C:________。
(2)A元素的离子结构示意图为__________________________________________。
(3)用电子式表示AB2的形成过程__________________________________
________________________________________________________________________。
(4)C的气态氢化物与B的气态氢化物反应时有________________现象发生,生成物的化学式为________,它属于________化合物。
A+和B2-都与Ar具有相同的电子层结构,则A的元素符号为________,B元素的原子结构示意图为____________,它们形成的化合物的电子式为________________,A+和B2-离子半径大小比较为________________。
(12分)化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为________。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为________________________。
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y的单质的电子式为________;Z分子的结构呈________。
②A的化学式是________。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是______________________________________________。
(12分)A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。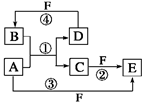
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应④的化学方程式为___________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,其离子方程式是_________________________________________________,
已知光照条件下D与F反应生成B,写出该反应的化学方程式:_________________________。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为____________________________。