(12分)化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为________。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为________________________。
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y的单质的电子式为________;Z分子的结构呈________。
②A的化学式是________。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是______________________________________________。
有下列物质:①氢氧化钠固体 ②铝片 ③氯化氢气体 ④稀硫酸
⑤干冰 ⑥氨水 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠
⑩CuSO4•5H2O晶体。请用序号填空:
(1)上述状态下可导电的是________。
(2)属于电解质的是________。
(3)属于非电解质的是________。
(4)上述状态下的电解质不能导电的是________。
在标准状况下,(a)4 g H2(b)11.2 L O2(c)27mL H2O中,所含分子数最多的是(填序号)①_________,含原子数最多的是②,体积最大的是③,质量由大到小的顺序是④。
根据图示填空。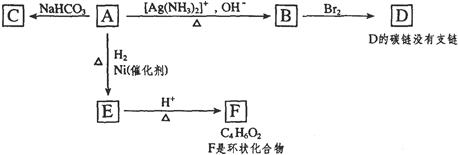
(1)化合物A含有的官能团是。
(2)1mol A与2mo H2反应生成1moE,其反应方程式是。
(3)与A具有相同官能团的A的同分异构体的结构简式是。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是。
(5)F的结构简式是。由E生成F的反应类型是。
(8分)将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L。min),且此时A、B的物质的量浓度之比为3∶5。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L。min),且此时A、B的物质的量浓度之比为3∶5。求:
(1)此时A的浓度为 .反应开始前放入容器中A、B的物质的量
(2)B的平均反应速率 .
(3)x的值是多少 .
(4)下列叙述能证明该反应已达到化学平衡状态的是。
A.溶器内压强不再发生变化
B.A的体积分数不再发生变化
C.容器内气体分子总数不再发生变化
D.相同时间内消耗3nmolA的同时消耗nmolB
E. 混合气体的平均相对分子质量不再变化
(8分)有A、B、C、D四种短周期元素,其原子序数依次增大。A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
(1)A2B2的电子式为____________。
(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1 L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图所示)。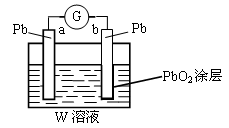
在b电极上发生的反应可表示为:PbO2+4H++SO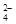 +2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W的浓度由质量分数39 % (密度1.3 g / cm3)变为______mol /L。
+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W的浓度由质量分数39 % (密度1.3 g / cm3)变为______mol /L。
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为____________________________________。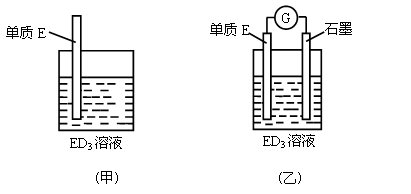
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池(图乙),则在该原电池工作时,石墨一极发生的反应可以表示为______________________________。