肼(N2H4)—空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH
溶液。电池总反应为:N2H4+O2=N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是
| A.负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2↑ | |
| B.正极的电极反应式是:O2+4H++4e-=2H2O | |
| C.溶液中阴离子向正极移动 | D.溶液中阴离子物质的量浓度基本不变 |
用下列实验装置进行相应实验,能达到实验目的是:
用下列实验装置进行相应实验,装置正确且能达到实验目的是: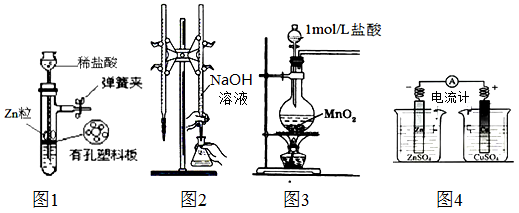
| A.用图1所示装置制取少量H2 |
| B.用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 |
| C.用图3所示装置制取少量Cl2 |
| D.用图4所示装置确定导线中有电流通过并确定电流方向 |
下列实验方案设计中,能达到实验目的的是:
| 选项 |
实验目的 |
实验方案 |
| A |
验证二氧化硫漂白性 |
二氧化硫通入溴水中,看溶液颜色是否褪色 |
| B |
检验氯化铁溶液中是否含FeCl2 |
向氯化铁溶液中滴加氢氧化钠溶液 |
| C |
检验食盐中是否添加KIO3 |
取食盐试样,溶于KI溶液,加入淀粉溶液,观察溶液是否变蓝 |
| D |
验证Ksp(AgI)>Ksp(AgCl) |
向含等物质的量NaCl、KI的混合液中滴加AgNO3溶液,观察沉淀颜色 |
下列关于右图所示转化关系(X代表卤素)的说法错误的是: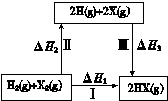
| A.2H(g) +2X(g) = 2HX(g)ΔH3<0 |
| B.ΔH1 = ΔH2 + ΔH3 |
| C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量按Cl、Br、I的顺序依次增多 |
| D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定 |
下列各组离子在指定溶液中可能大量共存的是
①无色透明溶液中:K+、Ca2+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、 [Al(OH)]4-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c(OH-) =10-4mol·L-1的溶液中:NH4+、Al3+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、NH4+、SCN-、Cl-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
| A.①②④ | B.③⑥ | C.②④ | D.①③⑤⑥ |