A、B、C、D、E、F为短周期六种元素,原子序数依次增大,其中A与E同主族且能形成离子化合物EA,B与F同主族,E与F同周期。D的核电荷数是B的最外层电子数2倍,单质F是一种重要的半导体材料。则下列推断中不正确的是
A.由A、C、D三种元素组成的化合物可以是离子化合物
B.F与D形成的化合物熔点高,可以与某种酸反应
C.五种元素中最高价氧化物对应的水化物酸性最强的是D
D.原子半径由大到小的顺序是:E>F>C>D
【改编】已知维生素A的结构简式如下,关于它的说法正确的是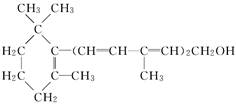
| A.维生素A是一种芳香族化合物 |
B.维生素A的一个分子中含有三个 |
| C.维生素A能够与金属钠反应生成氢气 |
| D.维生素A不能使溴的CCl4溶液褪色 |
【改编】下列4个反应中,反应类型与其他三个不同的是
| A.由苯制取硝基苯 | B.用乙酸和乙醇制备乙酸乙酯 |
| C.由液溴和苯制取溴苯 | D.由溴乙烷制乙烯 |
为探究一溴环己烷(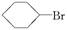 )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是
| A.甲 | B.乙 |
| C.丙 | D.上述实验方案都不正确 |
下列物质属于芳香烃,但不是苯的同系物的是
①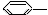 CH3②
CH3②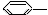 CH=CH2③
CH=CH2③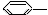 NO2
NO2
④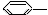 OH ⑤
OH ⑤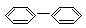 ⑥
⑥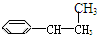
| A.③④ | B.②⑤ | C.①②⑤⑥ | D.②③④⑤⑥ |
分子式为C4H9Cl的同分异构体有
| A.1种 | B.2种 | C.3种 | D.4种 |