N2(g)+3H2(g) 2NH3(g)在体积不变的密闭容器中反应,下列叙述表示处于化学平衡状态的是
2NH3(g)在体积不变的密闭容器中反应,下列叙述表示处于化学平衡状态的是
| A.N2、H2、NH3的浓度比为1:3:2的状态 |
| B.混合气体的密度不随时间而变化 |
| C.当有1molN≡N键断裂时,有6molN-H键断裂 |
| D.单位时间内消耗amolN2的同时,消耗3amol的H2的状态 |
元素处于基态时的气态原子获得一个电子成为-1价阴离子时所放出的能量叫做该元素的第一 电子亲和能。-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能。下表中给出了几种元素或离子的电子亲和能数据:
电子亲和能。-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能。下表中给出了几种元素或离子的电子亲和能数据:
| 元素 |
Li |
Na |
K |
O |
O- |
F |
| 电子亲和能/kJ·mol-1 |
59.8 |
52.7 |
48.4 |
141 |
-780 |
327.9 |
下列说法正确的是()
| A.电子亲和能越大,说明越难得到电子 |
| B.一个基态的气态氟原子得到一个电子成为氟离子时放出327.9kJ的能量 |
| C.氧元素的第二电子亲和能是-780 kJ·mol-1 |
| D.基态的气态氧原子得到两个电子成为O2- 需要吸收能量 |
关于CS2、SO2、NH3三种物质的说法中正确的是()
| A.CS2在水中的溶解度很小,是由于其分子属于非极性分子 |
| B.SO2和NH3均易溶于水,原因之一是它们都是极性分子 |
| C.CS2为非极性分子,所以在三种物质中熔沸点最低 |
| D.NH3在水中的溶解度很大只是由于NH3是极性分子 |
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是()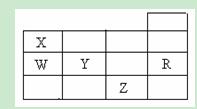
A.常压下五种元素的单质中, Z单质的沸点最高 Z单质的沸点最高 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物的沸点比X的氢化物的沸点高 |
| D.Y元素的非金属性比W元素的非金属性强 |
下列过程与配合物的形成无关的是()
| A.向一定量的硝酸银溶液中加入氨水至过量 |
| B.除去铁粉中的氧化铝可用强碱溶液 |
| C.向一定量的硫酸铜溶液中加入氨水至沉淀消失 |
| D.向Fe3+溶液中加入KSCN溶液后溶液呈血红色 |
下列说法中不正确的是 ()
| A.HCl、HBr、HI的熔点沸点升高与范德华力大小有关 |
B.NH3的熔点沸点大于PH3的是由于NH3分子之间存在 氢键 氢键 |
| C.甲烷和水分子之间可以形成氢键 |
| D.乙醇与水互溶可以用相似相溶原理解释 |