(每空2分,共8分)
(1)下列所列的是中学化学实验室中几种常见的玻璃仪器:
①集气瓶 ②容量瓶 ③滴定管 ④烧杯 ⑤圆底烧瓶 ⑥量筒 ⑦温度计
可作反应容器并可加热的是 (填写编号),用以精确量取液体体积的是
(填写编号)
(2)在“用氢氧化钠溶液、碳酸钠溶液、氯化钡溶液、盐酸、水等试剂除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子以获得纯净的食盐”的实验中,玻璃棒的作用可能是
(填写编号)
①搅拌 ②引流 ③蘸取溶液
(3)在仪器:①漏斗②容量瓶③蒸馏烧瓶④分液漏斗⑤烧杯⑥蒸发皿中,分离两种沸点接近且互不相溶的液体时会用到的有 (填写编号)
氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。
实验室制备装置和工业制备流程图如下:
已知:(1)无水FeCl3的熔点为555 K、沸点为588 K。(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
20 |
80 |
100 |
| 溶解度(g/100 g H2O) |
74.4 |
91.8 |
525.8 |
535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。请回答:
(1)烧杯中足量的H2O2溶液的作用是 。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是 。
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入 后、 过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式: 。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式(相对式量:Cl-35.5、Fe-56)为 。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-═2I-+S4O62-)。
①滴定终点的现象是: ;
②样品中氯化铁的质量分数 ;
(10分) 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下: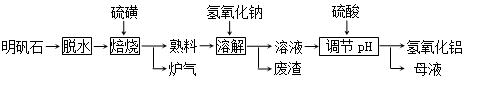
回答下列问题:
(1)“焙烧”过程中发生的反应为2Al2(SO4)3+3S  2Al 2O3+9SO2,其中氧化剂为 。
2Al 2O3+9SO2,其中氧化剂为 。
(2)“溶解”时反应的离子方程式为 。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是 。
(4)调节pH时使用的是质量浓度(单位体积溶液所含溶质的质量)为882 g/L 的H2SO4 ,配制1L该溶液,需用量筒量取质量分数为98﹪的硫酸(密度是1.8g/cm3) mL。
(5)“母液”中可回收的物质是 。
(14分)欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一:
方法二: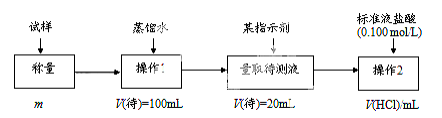
方法三: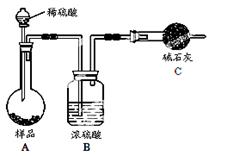
方法四:不使用化学试剂,使用实验室常用仪器
按要求回答下列问题:
(1)方法一:加入足量的试剂A (填写A的化学式)可将HCO3-离子转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、 、洗涤和烘干;
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要的用到的是 ,在操作2中应选择的指示剂是 ;
(3)在方法二中计算该样品中NaHCO3的质量分数为 [用流程图中的数据m、V(HCl) 填写有关的表达式];
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是 ;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是 ,偏低的原因可能是(均文字简述) ;
(6)方法四的实验原理是: (用化学方程式表示)。
某研究小组以粗盐和碳酸氢铵(NH4HCO3)为原料,采用以下流程制备纯碱和氯化铵。
已知盐的热分解温度: NH4HCO3 36℃; NaHCO3 270℃; NH4Cl 340℃; Na2CO3 >850℃
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:①NaOH ②BaCl2 ③HCl ④Na2CO3,其加入的顺序合理的是
| A.①③④② | B.①②④③ | C.③②④① | D.①②③④ |
过滤中用到玻璃棒的作用是 ;
(2)如何判断粗盐中SO42-是否已除尽? ;
(3)从NaCl溶液到沉淀1的过程中,需蒸发浓缩。在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3之后,原因是 ;
(4)写出沉淀1受热分解的化学方程式 ;
(5)为提高NH4Cl产品的产率和纯度,需在滤液中加入氨水,理由是 ;
步骤X包括的操作有 ;
(6)采用“甲醛法”测定工业产品中氯化铵的纯度(假定杂质不与甲醛反应),反应原理为:4NH4Cl+6HCHO→(CH2)6N4+4HCl+6H2O 某技术人员称取1.5g该样品溶于水,加入足量的甲醛并加水配成100mL溶液。从中取出10mL,滴入酚酞再用0.1mol/L的NaOH溶液滴定,到滴定终点时消耗NaOH溶液25.00mL。则该样品中氯化铵的质量分数为 。
(12分)SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如下:
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡 [Sn(OH)Cl]。
(1) 写出物质A的名称:___ _____。
(2) SnCl2用盐酸而不用水溶解的原因是__________ __________(用化学方程式表示)。
(3) 锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式:__________________。
(4) 反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:_ _ __。该反应的温度需要控制在75 ℃左右的原因是_ _ _ _。
(5) 实验室中“漂洗”沉淀的实验操作方法是_ _ __。