[2012·潍坊一模] 黄铜矿的主要成分是CuFeS2,是工业炼铜的主要原料。已知黄铜矿在空气中焙烧生成Cu、FeS和SO2,FeS+2HCl=FeCl2+H2S↑,H2S是一种剧毒气体。某科研小组设计以黄铜矿为原料制取单质铜和氯化铁晶体(FeCl3·6H2O)的流程如下:

(1)92gCuFeS2在空气中焙烧生成Cu、FeS和SO2转移电子的物质的量为 。
(2)请简述检验气体Ⅰ的操作步骤 。
(3)在实验室中,欲用38%(密度为1.18g·mL-1)的盐酸配制30%的盐酸,需要的玻璃仪器主要有 。
(4)气体Ⅲ最好选用 (填写序号),其主要作用是 。
| A.O2 | B.H2 | C.Cl2 | D.N2 |
欲选用下列仪器在实验室中制取纯净干燥的该气体。
装置A中发生反应的离子方程式为 。
选用合适装置导管口的连接顺序为a接 。图中仪器G的名称是 ;在使用该仪器时,应首先 。
德国化学家凯库勒认为:苯分子是由6个碳原子以单双键相互交替结合而成的环状结构。为了验证凯库勒有关苯环的观点,甲同学设计了如下实验方案。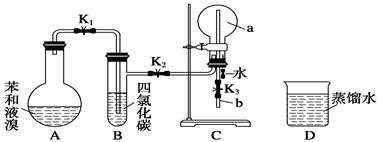
①按如图所示的装置图连接好各仪器;
②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开止水夹K1、K2、K3;
④待C中烧瓶收集满气体后,将导管b的下端插入烧杯里的水中,挤压预先装有水的胶头滴管的胶头,观察实验现象。
请回答下列问题。
(1)A中所发生反应的反应方程式为_____________________,
能证明凯库勒观点错误的实验现象是_____________________________;
(2)装置B的作用是____________________;
(3)C中烧瓶的容积为500 mL,收集气体时,由于空气未排尽,最终水未充满烧瓶,假设烧瓶中混合气体对H2的相对密度为37.9,则实验结束时,进入烧瓶中的水的体积为________mL(空气的平均相对分子质量为29);
(4)实验前应对A、B、C三个装置的气密性进行逐一检查,则检查装置C气密性的方法为_______________________________________。
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 |
金属质量/g |
金属状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
| 2 |
0.10 |
块状 |
0.8 |
50 |
20 |
35 |
200 |
| 3 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
| 4 |
0.10 |
块状 |
1.0 |
50 |
20 |
35 |
125 |
分析上述数据,请回答下列问题。
(1)实验1和3表明,对反应速率有影响,能表明这种影响因素的实验还有(填实验序号)。
(2)本实验中影响反应速率的其他因素还有,其实验序号是。该实验说明,则反应速率越快;
(3)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:
。
从海水提取镁和溴的流程如下,请回答相关问题。
(1)从海水中提取镁的流程如下图所示(框图中是主要产物):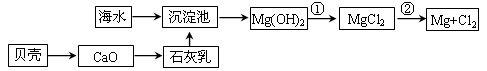
i.海水进入沉淀池前,对海水进行处理有以下两种方案:
方案一:将晒盐后的卤水通入沉淀池;
方案二:将加热蒸发浓缩后的海水通入沉淀池。
你认为方案________更合理,理由是_________________________________________。
ii.反应①的离子方程是________________________________________________。
反应②的化学方程式是_______________________________________________。
(2)从海水中提取溴的流程如下图所示(框图中是主要产物):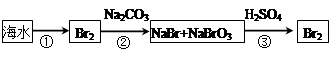

i.过程①中,加入的试剂是___________。
ii.过程②中,向混合液中吹入热空气,将溴吹出,用纯碱吸收,吹入热空气的目的是______________________________________________________________________。
iii.过程③中反应的化学方程式是____________________________________________。
iv.若最终得到的溴单质中仍然混有少量的Cl2,则除去该杂质的方法是__________________________________________________(结合离子方程式回答)。
实验室制乙烯时,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。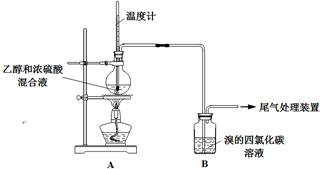
实验操作和现象:
| 操 作 |
现 象 |
| 点燃酒精灯, 加热至170℃ |
Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| …… |
|
| 实验完毕, 清洗烧瓶 |
Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)烧瓶内产生乙烯的化学方程式是_____ 。
(2)溶液“渐渐变黑”,说明浓硫酸具有性。
(3)分析使B中溶液褪色的物质,甲认为是C2H4,乙认为不能排除SO2的作用。
① 根据甲的观点,使B中溶液褪色反应的化学方程式是。
② 乙根据现象Ⅲ认为产生了SO2,在B中与SO2反应使溶液褪色的物质是。
③ 为证实各自观点,甲、乙重新实验,设计与现象如下:
| 设 计 |
现 象 |
|
| 甲 |
在A、B间增加一个装有某种试剂的洗气瓶 |
Br2的CCl4溶液褪色 |
乙 |
与A连接的装置如下: |
D中溶液由红棕色变为浅红棕色时,E中溶液褪色 |
a. 根据甲的设计,洗气瓶中盛放的试剂是______。
b. 根据乙的设计,C中盛放的试剂是_____。
c. 能说明确实是SO2使E中溶液褪色的实验是____。
d. 乙为进一步验证其观点,取少量D中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是_____。
(4)上述实验得到的结论是。
某化学课外小组用如图所示装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。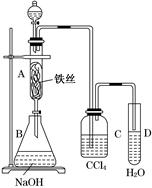
(1)写出A中反应的化学方程式________________。
(2)观察到A中的现象是____________________________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________________,写出有关的化学方程式___________________。
(4)C中盛放CCl4的作用是____________________。
(5)若证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入___,现象是_______________________ 。