工业上用固体硫酸亚铁制取Fe2O3,反应原理是: 2FeSO4 Fe2O3 +SO2↑+SO3↑某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量(已知SO2沸点为- 10. 02℃)
Fe2O3 +SO2↑+SO3↑某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量(已知SO2沸点为- 10. 02℃)
请回答相关问题:
(1)Fe2O3俗称为 不溶于水而易溶于酸,Fe2O3与稀盐酸反应的离子方程式为
(2)A瓶所盛试剂的作用是 C瓶所盛试剂的作用是
,用冷水冷却的原因是 ;B瓶所盛的试剂是
(3)将此反应生成的气体通入A瓶的BaCI2溶液中,下列说法正确的是 (填编号)
| A.析出BaSO3沉淀 | B.析出BaSO4沉淀 | C.逸出SO3气体 | D.逸出SO2气体 |
理由是
(4)在用固体硫酸亚铁制取Fe2O3的反应中,还原产物是 ,标准状况下每生成11. 2L SO2气体,转移电子的物质的量为 mol.
以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。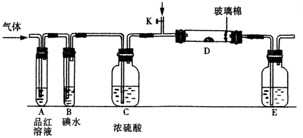
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?(填“相同”或“不相同”);若置D装的是铁粉,通入Cl2与铁粉充分反应时现象为
;若装置D中装的是五氧化二钒(催化剂)。通入SO2时,打开K通入适量O2的化学反应方程式为。
②若装置B中装有5.0 mL 1.0×10-3mol/L在碘水,当通入足量Cl2完全反应后,共转移了5.0×10-5mol电子,该反应的化学方程式为。
③E中盛有溶液。
(2)某同学将足量的SO2通入一支装有氧化钡溶液的试管,未见沉淀生成,若向该试管中加入加量(填字母),则可以看到白色沉淀产生。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 |
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2的与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式。
某同学想通过比较两种最高价氧化物对应水化物的酸性强弱来验证硫与碳的非金属性的强弱,他采用了如图所示的装置。请回答: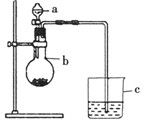
(1)仪器a的名称是,应盛放下列药品中的。
A.稀硫酸 B.亚硫酸
C.氢硫酸 D.盐酸
(2)仪器b的名称是,应盛放下列药品中的。
A.碳酸钙 B.硫酸钠
C.氯化钠 D.碳酸钠
(3)如果观察到C中的现象为,即可证明硫与碳的非金属性的强弱。
(9分) 四氯化钛是无色液体,沸点为136℃。它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑),在650℃~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。下图是实验室制备TiCl4的反应装置,其主要操作步骤如下:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④ 将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。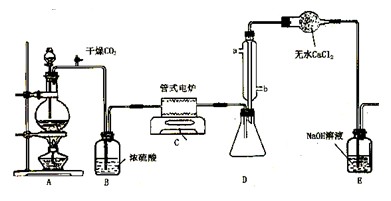
试回答下列问题:
(1)正确的操作顺序为(填序号)。
(2)装置A中的反应的离子方程式为。
(3)C装置中的反应方程式为:。
(4)操作①的目的是。
(5)装置D中冷凝管进水口的位置是(填a或b),装置E的作用是。
为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。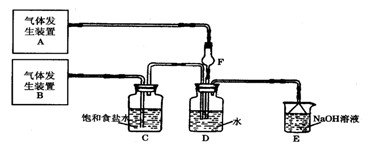
试填空。
(1)D装置中主要反应的离子方程式为,
F仪器的作用是:。
(2)为验证通入D装置中气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂: ① 氯化铁稀溶液 ② 氯化亚铁溶液 ③ 硫氰化钾溶液
① 氯化铁稀溶液 ② 氯化亚铁溶液 ③ 硫氰化钾溶液
④ 苯酚溶液 ⑤ 品红溶液 ⑥ 酸性高锰酸钾溶液
若Cl2过量:取适量D中溶液滴加至盛有(选填一个序号)试剂的试管内,再加入(选填一个序号)试剂,发生的现象是:;
若SO2过量:取适量D中溶液滴加至盛有(选填一个序号)试剂的试管内,发生的现象是:。
实验室利用下图所示装置制取乙酸乙酯。请回答:
(1)试管A中盛放的试剂为乙酸、和浓硫酸,它们之间发生反应生成乙酸乙酯的化学方程式为。
(2)加热一段时间后,可观察到B试管中液面上有无色油状液体生成。B试管中的导管不伸入液面下的原因是(填序号)。
①防止溶液倒吸②避免反应过快