PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
| |
熔点/℃ |
沸点/℃ |
密度/g·mL-1 |
其他 |
| 黄磷 |
44.1 |
280.5 |
1.82 |
2P(过量)+3Cl2 2PCl3;2P+5Cl2(过量) 2PCl3;2P+5Cl2(过量) 2PCl5 2PCl5 |
| PCl3 |
—112 |
75.5 |
1.574 |
遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 |
2 |
105.3 |
1.675 |
遇水生成H3PO4和HCl,能溶于PCl3 |
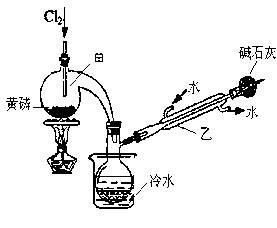
(一)制备:右图是实验室制备PCl3的装置(部分仪器已省略)
(1)仪器乙的名称 。
(2)实验室用漂白粉加浓盐酸制备Cl2的化学方程式: 。
(3)碱石灰的作用是 。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间的CO2,其目的是 。
(二)提纯:
(5)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到PCl3的纯品。
下图所示为某化学兴趣小组设计的乙醇催化氧化及其产物检验的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。
图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液。
(1)在上述装置中,实验时需要加热的仪器为(填仪器或某部位的代号)。
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是_____________。
D处使用碱石灰的作用是。
(3)检验乙醇氧化产物时F中的实验现象是。
(4) E处是一种纯净物,其反应方程式为。
(5)写出乙醇发生催化氧化的化学方程式。
已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,某探究小组用KMnO4酸性溶液与H2C2O4(草酸)溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 mol· L—1、0.0010 mol· L—1,催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol· L—1)的用量均为2 mL。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
催化剂的用量 / g |
酸性KMnO4溶液的浓度/mol·L-1 |
实验目的 |
| ① |
298 |
0.5 |
0.010 |
a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b. 实验①和③探究温度对反应速率的影响; c. 实验①和④探究催化剂对反应速率的影响。 |
| ② |
||||
| ③ |
||||
| ④ |
(2)某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 |
溶液褪色所需时间 t / min |
||
| 第1次 |
第2次 |
第3次 |
|
| ① |
14.0 |
13.0 |
11.0 |
| ② |
6.5 |
6.7 |
6.8 |
则实验②中用KMnO4的浓度变化来表示的平均反应速率为(忽略混合前后溶液的体积变化)。
(将下图所列仪器组装为一套实验室蒸馏石油的装置,并进行蒸馏,得到汽油和煤油。
(1)图中A、B、C三种仪器的名称是_________。。
(2)将以上仪器按(一)→(六)顺序,用字母a,b,c,…表示连接顺序:
e接( );( )接( );( )接( );( )接( );( )接( )
(3)A仪器中c口用于_________,d口用于_________。
(4)蒸馏时,温度计水银球应在_________位置。
(5)在B中注入原油后,加几片碎瓷片的目的是_________。
如果在试管甲中先加入2 mL 95%的乙醇,并在摇动下缓缓加入2 mL浓硫酸,充分摇匀,冷却后再加入2 g无水乙酸,用玻璃棒充分搅拌后将试管固定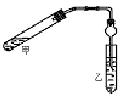
在铁架台上,在试管乙中加入5 mL饱和碳酸钠溶液,按右图连接装置,用酒精灯对试管甲加热,当观察到试管乙中有明显现象时停止加热。试回答:
(1)试管乙中观察到的现象是。
(2)加入浓硫酸的目的是。
(3)该实验用到的球形管除冷凝作用外,另一重要作用是。
(4)试管乙中饱和Na2CO3溶液的作用是。
课本实验设计得简要明了,但也常存在一些不足,在学习过程中对其进行分析与改进是研究性学习的一个重要课题。
Ⅰ.草酸晶体(H2C2O4·2H2O)受热易分解(分解温度为175℃),产生CO和CO2。关于草酸晶体受热分解及验证部分分解产物的实验装置如图。
(1)写出草酸晶体受热分解的化学方程式:
__________。
(2)设计该装置欲验证的分解产物是。
(3)草酸晶体的某些物理性质如下表:
| 分子式 |
颜色、状态 |
水溶性 |
熔点/℃ |
密度/g·cm—3 |
|
| 草酸晶体 |
H2C2O4·2H2O |
无色晶体 |
易溶于水 |
101.5 |
1.650 |
有同学认为,用该装置进行实验,存在着不合理因素,请分析指出(任答两点):
①
②
Ⅱ.下图甲是 “铜丝在氯气中燃烧”的演示实验,铜丝在氯气中燃烧的主要现象是。有人对该实验提出了如下改进方案:
①按下图乙所示连接好装置,并检查气密性;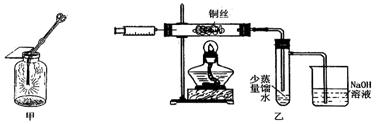
②取下注射器并集满Cl2;
③点燃酒精灯加热1~2min后,再移开酒精灯。迅速将注射针插入石英玻璃管内,并将Cl2缓缓推入玻璃管中;
④拔出针头,再用同样方法快速向玻璃管中推入空气。请回答:
(1)步骤③中,移开酒精灯、推入Cl2时,观察到铜丝继续保持红热状态,由此可判断,该反应为反应(填“放热”或“吸热”)。 (2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有色的沉淀产生,该反应的离方程式为。
(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有色的沉淀产生,该反应的离方程式为。
(3)改进后的实验与课本实验相比较,其优点为
______________。