硫酸亚铁是一种重要的工业原料,实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备绿矾(FeSO4·7H2O)晶体,工艺流程如下所示:

(1)将过程③中的产生的气体通入下列溶液中,溶液不会褪色的是__________;
| A.品红溶液 | B.红色的酚酞试液 |
| C.酸性KMnO4溶液 | D.紫色石蕊溶液 |
(2)Z是_____,此时溶液X中发生反应的离子方程式为_____________________________。
(3)检验溶液Y中含有金属阳离子的实验方法是______________________。
(4)操作Ⅲ、Ⅳ等实验操作步骤为蒸发、冷却结晶、 (填操作名称)、洗涤。
如下图所示,蒸发操作中的一处错误是 。

(5)测定绿矾产品中Fe2+含量的实验步骤:
a.称取6.0产品,溶解,在250mL容量瓶中定容;
b.量取25mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
①计算上述产品中FeSO4•7H2O的质量分数为________;
②若用上述方法测定的产品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有___________(只回答一条即可)。
某同学利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图所示,导管出口高于液面)。
⑥测量收集到的气体的体积。
⑦准确称量试管和残留物的质量为b g。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。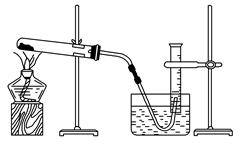
回答下列问题:
(1)如何检查装置的气密性?。
(2)以下是测量收集到的气体体积必须包括的几个步骤:
①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是(请填写步骤代号)。
(3)测量收集到的气体体积时,如何使量筒内外液面的高度相同?。
(4)如果实验中得到的氧气体积是c L(已换算为标准状况),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简)M(O2)=。
某实验小组利用反应2CuO+2Cl2 2CuCl2+O2测定铜的近似相对原子质量,可供选择的装置如图所示。
2CuCl2+O2测定铜的近似相对原子质量,可供选择的装置如图所示。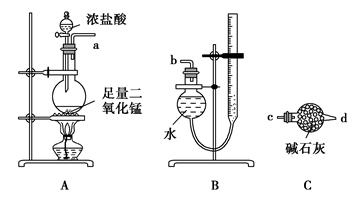
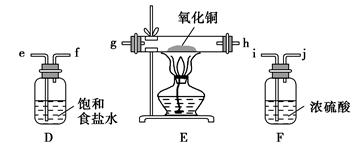
方案一:通过测定反应物CuO的质量m(CuO)和产物O2的体积V(O2)来测定铜的近似相对原子质量。
(1)按气流方向从左到右用胶管(图中未画出)将选择的仪器组合成一套实验装置,连接顺序为a→( )( )→( )( )→( )( )→( )( )→b。
(2)装置B是由干燥管和碱式滴定管改造而成的测量气体体积的装置,实验前滴定管液面初读数为V1 L,实验后恢复到室温,调节装置两侧液面相平后得到末读数为V2 L,设室温时气体摩尔体积为Vm L·mol-1,且E装置中CuO的质量为m1 g,充分反应后生成CuCl2的质量为m2 g,则铜的近似相对原子质量的表达式为
[用含m1、V1、V2的代数式表示]。
(3)若氧化铜中混有铜,则测定结果(填“偏大”、“偏小”或“无影响”)。
(4)装置E在实验过程中的主要现象是。
方案二:利用A、D、E、F四套装置(尾气由其他的装置处理)完成测定任务。
(5)你认为测定的物理量有(写出一组),按你测定的物理量,写出铜的近似相对原子质量的表达式:。
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得
高纯硅。以下是实验室制备四氯化硅的装置示意图。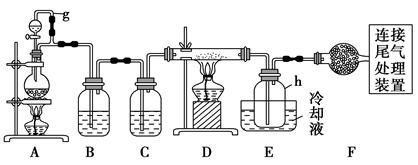
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
| 沸点/℃ |
57.7 |
12.8 |
- |
315 |
- |
| 熔点/℃ |
-70.0 |
-107.2 |
- |
- |
- |
| 升华温度/℃ |
- |
- |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:。
(2)装置A中g管的作用是;装置C中的试剂是;装置E中的h瓶需要冷却的理由是。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是(填写元素符号)。
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用过量的碳还原二氧化硅制得粗硅,同时得到一种可燃性气体;
②粗硅与干燥的HCl气体反应制得SiHCl3(Si+3HCl SiHCl3+H2);
SiHCl3+H2);
③SiHCl3与过量的H2在1 100~1 200 ℃的温度下反应制得纯硅,已知SiHCl3能与水剧烈反应,在空气中易自燃。
请回答:
(1)第一步制取粗硅的化学反应方程式为。
(2)粗硅与HCl气体反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为。
(3)实验室用SiHCl3与过量的H2反应制取纯硅装置如图所示(加热和夹持装置略去):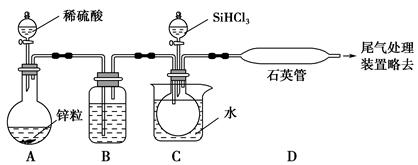
①装置B中的试剂是,装置C中的烧杯需要加热,目的是。
②反应一段时间后,装置D中观察到的现象是,装置D不能采用普通玻璃管的原因是,装置D中发生反应的化学方程式是。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及。
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)提出猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含有(填化学式,下同)。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含有。
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。
供选用的试剂:
a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)。
| 选用试剂 |
实验现象 |
|
| 方案1 |
||
| 方案2 |
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色,所发生的反应的离子方程式为。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为。
的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为。