有机物的结构式可用“键线式”简化表示。如CH3一CH=CH一CH3可简写为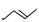 。有机物X的键线式为:
。有机物X的键线式为: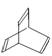 。下列说法不正确的是
。下列说法不正确的是
| A.X与苯中碳元素的质量分数相同 |
| B.有机物Y是X的同分异构体,且属于芳香烃,能使溴水褪色,则Y为苯乙烯; |
| C.X能使酸性高锰酸钾溶液褪色 |
| D.X 与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有四种 |
氯化硼的熔点为-107℃,沸点为12.5℃,它能水解,有关叙述正确的是()
| A.氯化硼液态时能导电而固态时不导电 |
| B.氯化硼加到水中使溶液的pH升高 |
| C.氯化硼分子呈正三角形,属极性分子 |
| D.氯化硼遇水蒸气会产生白雾 |
下列有关物质性质、结构的表述均正确,且存在因果关系的是( )
| 表述Ⅰ |
表述Ⅱ |
|
| A |
在水中,NaCl的溶解度比I2的溶解度大 |
NaCl晶体中C1—与Na+间的作用力大于碘晶体中分子间的作用力 |
| B |
通常条件下,CH4分子比PbH4分子稳定性高 |
Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
| C |
在形成化合物时,同一主族元素的化合价相同 |
同一主族元素原子的最外层电子数相同 |
| D |
P4O10、C6H12O6溶于水后均不导电 |
P4O10、C6H12O6均属于共价化合物 |
下列说法不正确的是()
| A.元素的第一电离能(I1)是元素的单质失去最外层1个电子所需要吸收的能量,同周期从左到右元素的I1逐渐增大 |
| B.元素的电负性是衡量元素在化合物中吸引电子能力大小的一种标度,同主族从上到下元素的电负性逐渐减小 |
| C.含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中不一定含有阴离子 |
| D.原子晶体中一定含有共价键;离子晶体中一定含有离子键,可能含有共价键;分子晶体中一定存在分子间作用力 |
下列现象与氢键有关的是()
①NH3的熔、沸点比VA族其他元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子高温下也很稳定
| A.①②③④⑤⑥ | B.①②③④⑤ | C.①②③④ | D.①②③ |
对σ键的认识不正确的是()
| A.σ键不属于共价键,是另一种化学键 |
| B.s-s σ键与s-p σ键的对称性相同 |
| C.分子中含有共价键,则至少含有一个σ键 |
| D.含有π键的化合物与只含σ键的化合物的化学性质不同 |