以下是元素周期表的示意图,请参照①~⑧在表中的位置,用化学用语回答下列问题:
(1)元素②和⑤的单质和化合物之间在一定条件下存在反应: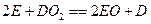 ,其中
,其中 为直线形的非极性分子。
为直线形的非极性分子。 的结构式为_________。
的结构式为_________。
(2)元素③的气态氢化物与最高价氧化物对应的水化物之间可以反应生成盐,该盐在实际生活中的一种用途为___________________________。
(3)元素⑥的单质既能与强酸反应,又能与强碱反应,且元素⑥的单质可以在高温条件下还原三氧化二铁。该反应的化学方程式为___________________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为_________(填一种物质的化学式)。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生如下反应:
①X溶液与Y溶液反应的离子方程式为___________________________。
② ⑥的单质化学方程式为___________________________。
⑥的单质化学方程式为___________________________。
③常温下,为使 溶液中由
溶液中由 电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至__________________。
电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至__________________。
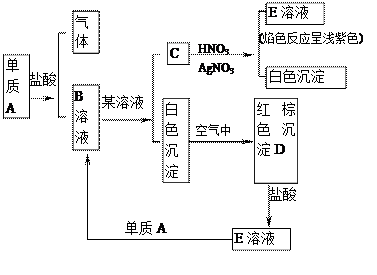
根据图指出A、B、C、D、E各是什么物质?
有机物A的化学式为C6H8O4Cl2,与有机物B、C、D、E的变化关系如下图:
1molA经水解生成2molB和1molC,根据上述变化关系填空:
(1)写出物质的结构简式:A 、 B 、 C 、D 、 E 。
(2)写出E转变为B的化学方程式: 。
一种用于治疗高血脂的新药灭脂灵是按如下路线合成的:已知:
已知G的分子式为C10H22O3,试回答:
(1)写出结构简式:B_________,G _______;
(2)上述反应中属于取代反应的是___________(填序号);
(3)写出反应方程式:
I、反应②___________________________________________________;
Ⅱ、反应⑤___________________________________________________
Ⅲ、F与银氨溶液反应: _______________________________________________
已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 |
a |
I |
e |
| 原子核数 |
单核 |
四核 |
双核 |
| 粒子的电荷数 |
一个单位正电荷 |
0 |
一个单位负电荷 |
物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
请填写下列空白:
(1)写出下列物质的化学式:B,J。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M
。
②I溶于G
。
(3)在通常状况下,若1 g C气体在B气体
中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为。
下图中A~J分别代表相关反应中的一种物质,已知A分解得到相等物质的量的B、C、D,图中有部分生成物未写出。
请填写以下空白:
⑴B的电子式______________,D分子的空间构型_________________。
⑵写出反应①、②的化学反应方程式:
①_____________________________________________________________;
②_____________________________________________________________。
⑶写出反应③的离子方程式:____________________________________________。