水解反应是中学化学中的一大类反应。
(1)在 ①酸 ②碱 ③盐 ④不饱和烃 ⑤卤代烃 ⑥醇 ⑦醛 ⑧酯 ⑨低聚糖 ⑩蛋白质等物质中,能发生水解的物质有 (填编号)。蔗糖水解的产物名称为 。
(2)写出二甲基二氯硅烷[(CH3)2SiCl2 ]水解得到二甲基硅二醇的化学方程式: 。
(3)溴乙烷水解实验的操作为:取一支试管,加入0.5 mL溴乙烷,再加入2 mL 5% 的NaOH溶液,充分振荡后静置,待液体分层后,用滴管小心吸取10滴上层水溶液,转入另一盛有10 mL稀HNO3溶液的试管中,然后加入3滴2 % 的AgNO3溶液,观察反应现象。
请根据上述操作回答以下问题:
①本实验中涉及溴乙烷的物理性质主要有 ,稀HNO3的作用是 。
②甲同学在盛溴乙烷和NaOH溶液的试管口塞紧带长玻璃管的单孔橡皮塞,然后水浴加热数分钟,最后液体不再分层。反应的化学方程式为 。
③乙同学认为:要证明上述实验中溴乙烷发生了水解反应,需要先做一个对比实验证明溴乙烷自身不能电离出溴离子,此实验操作步骤和现象是 。
(1)“绿色试剂”双氧水可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如KCN),反应的化学方程式为;KCN+H2O2+H2O=A+NH3↑
回答下列问题:
①生成物A的化学式为____________。
②在标准状况下若有0.448L氨气生成,则转移的电子数为____________。
③反应中被氧化的元素为____________。
(2)在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直 至过量。经测定,加入的NaOH的物质的量和所得沉淀的物质的量的关系如下图所示。则:
至过量。经测定,加入的NaOH的物质的量和所得沉淀的物质的量的关系如下图所示。则:
①原溶液 中c(Mg2+)∶c(Al3+)为。
中c(Mg2+)∶c(Al3+)为。
②图中C点表示当加入mol NaOH时,
Al3+已经转化为 ,
Mg2+已经转化为。
③图中线段OA∶AB=。
现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2 2MgO;②3Mg+N2
2MgO;②3Mg+N2 Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2 2MgO+C
2MgO+C
④Mg+H2O MgO+H2↑ ⑤Mg3N2 +6H2O ===3Mg(OH)2+2NH3↑
MgO+H2↑ ⑤Mg3N2 +6H2O ===3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别为________________________________;
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)___________;
(3)通气后,应先点燃处的酒精灯,再点燃处的酒精灯;如果同时点燃A、
F装置的酒精灯,对实验结果有何影响?__________,
原因是______;
(4)请设计一个实验,验证产物是Mg3N2,写出操作步骤、现象和结论:
______________________________________________________________________
(5)已知Mg3N2是离子化合物,请写出其电子式;
证明Mg3N2是离子化合物实验依据是。
Ⅰ.在实验室制备少量纯净的KCl。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。
(1)过滤时需要用到的玻璃仪器有 。
。
(2)检验加入BaCl2溶液后SO42-是否沉淀完全的操作为。
(3)若用硝酸钡来代替氯化钡,请判断是否可行,,理由是
(4)某同学认为该实验方案中加适量BaCl2溶液不容易控制,应加入过量BaCl2溶液。实验操作方案如下: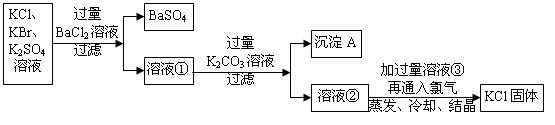
沉淀A的化学式是 ,溶液③中的溶质的化学式是。
Ⅱ.工业上制取漂白粉的化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
实验室有一瓶密封不严的漂白粉,其中肯定存在CaCl2,请设计实验,探究该固体中可能存在的其它物质。
(1)提出合理假设。
假设1:该漂白粉未变质,含有CaCl2,并含;
假设2:该漂白粉全部变质,含有CaCl2,并含;
假设3:该漂白粉部分变质,含有Ca Cl2,又含有Ca(ClO)2、CaCO3。
Cl2,又含有Ca(ClO)2、CaCO3。
(2)设计实验方案,进行实验。请在答题卡上写出实验步骤、预期实验现象和实验结论
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-,表格可以不填满。)
| 实验步骤 |
预期现象和结论 |
|
| ① |
取少量上述漂白粉于试管中, |
|
| ② |
||
| ③ |
实验室制备氯气的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,该反应中氧化剂与还原剂的物质的量之比为,请将该化学方程式改写为离子方程式______________________________,氯气的工业制法是电解饱和食盐水,请列举出氯气在生产、生活中的应用(两条)_________________,___________________;
MnCl2+Cl2↑+2H2O,该反应中氧化剂与还原剂的物质的量之比为,请将该化学方程式改写为离子方程式______________________________,氯气的工业制法是电解饱和食盐水,请列举出氯气在生产、生活中的应用(两条)_________________,___________________;
将氯气通入紫色石蕊试液中可观察到的现象是_______________________________。
用化学方程式说明酸性强弱顺序:HCl>H2CO3>HClO。
_________________________________;__________________________________