某研究小组在查阅资料中发现,常温下氯气可以氧化氨气获得氮气。该小组由此设计出制取氮气的思路,设计装置图如下。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置A中的烧瓶内固体不可以选用_________(填序号)。
A.生石灰 B.碱石灰 C.五氧化二磷 D.烧碱
(2)装置F发生反应的离子方程式是___________________________。
(3)B装置的作用_________;E装置的作用__________________。
(4)写出制取 的化学方程式__________________;反应生成
的化学方程式__________________;反应生成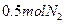 ,转移的电子数是_________
,转移的电子数是_________ 。
。
(5)当反应装置里的氨气和氯气的物质的量之比大于_________时,尾气里一定含有氨气;当反应装置里的氯气和氨气的物质的量之比大于_________时,尾气里一定含有氯气。
氯气是一种重要的化工原料,在生产和生活中的应用十分广泛。
(1)请写出实验室用二氧化锰和浓盐酸共热制取氯气的化学方程式。
(2)实验室欲制得氯气1.12 L,理论上需要消耗二氧化锰多少克?
(3)①若用3.36 L 氯气与4.0 mol/L的NaOH溶液反应制取简易消毒液,则需要多少毫升这种NaOH溶液能与氯气恰好完全反应?
②实验发现,该反应产物的质量明显小于理论值,可能的原因是
。
实验室用Na2CO3固体配制250 mL 0.1 mol/L的Na2CO3溶液。请填写下列空白:
(1)实验时,应用托盘天平称取Na2CO3固体g。
(2)在配制Na2CO3溶液时需用的玻璃仪器主要有量筒、烧杯、玻璃棒、、
。
(3)实验中两次用到玻璃棒,其作用分别是___________、__________。
(4)若实验过程中遇到下列情况,则会造成所配溶液浓度偏低的有_____。(填序号)
| A.转移前,容量瓶中含有少量蒸馏水 |
| B.转移时,有少量溶液溅出 |
| C.定容时,仰视刻度线 |
| D.定容时,俯视刻度线 |
某兴趣小组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如下图实验装置。请回答:
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为; C中反应的离子方程式为
(2)为了实现绿色环保的目标,某同学设计了上图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是
(3)试验中发现Na2SO3可能部分被氧化,现需测定Na2SO3的纯度:称取10.00g产品,配成100ml溶液,移取25.00ml溶液,用0.20mol/L酸性KMnO4溶液进行滴定,消耗KMnO4溶液20.00mL,产品中Na2SO3质量分数的计算表达式为,计算结果为。(保留两位小数)
发酵粉是一种化学膨松剂,可由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成。某小组为探究不同品牌的发酵粉的化学成分,进行如下实验。
【提出假设】
(1)假设1:由小苏打和臭粉组成 假设2:由小苏打和明矾组成 假设3:由______组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象:
(2)结合步骤①~③分析,气体A为____,该发酵粉的成分为__ (填化学式)。
(3)乙品牌的发酵粉的化学组成可能为假设2情况,请你设计实验验证。
实验仪器和用品任选,限选试剂:稀盐酸、0.1mol/LnaOH溶液
写出实验步骤、预期现象和结论。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量样品溶于足量的盐酸后,将溶液分成两份,分别装入A、B试管中。 |
|
| 步骤2: |
焰色呈黄色证明有Na+,发酵粉中有NaHCO3 |
| 步骤3: |
看到有白色沉淀生成(或先产生白色沉淀后沉淀溶解),证明发酵粉中有明矾。 |
工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3 ),具体生产流程如下:
试回答下列问题:
(1)滤液X中含有的金属阳离子是(填离子符号)。
(2)步骤Ⅲ中可选用试剂调节溶液的pH(填字母)。
| A.稀硝酸 | B.氨水 | C.氢氧化钠溶液 | D.高锰酸钾溶液 |
(3)过滤操作中除了玻璃棒、烧杯还需要的玻璃仪器是。
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为。