某学生设计如下图Ⅰ装置,测定2 mol/L的硫酸与锌粒和锌粉反应的速率。请回答: 
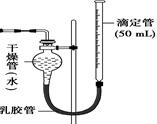
图Ⅰ 图Ⅱ
(1)装置图Ⅰ中放有硫酸的仪器名称是 。
(2)按照图Ⅰ装置实验时,他限定了两次实验时间均为10 min,他还需要测定的另一个数据是 。
(3)实验结束后,得到的结论是 。
(4)该生又将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验完毕待冷却后,该生准备读取滴定管上液面所在处的刻度数,发现滴定管中液面高于干燥管中液面,应首先采取的操作是 。
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关利用Fe粉与稀HNO3制备Fe(NO3)3溶液的方法,最佳的是 。
a.把过量的铁粉与稀HNO3反应
b.把铁粉与过量的稀HNO3反应
c.先把铁粉灼烧,再溶解于稀HNO3 中
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学为了验证假设1,取上述实验后的溶液,检验Fe2+。检验Fe2+的方法: ,甲同学观察到的实验现象为: ,甲同学检验出Fe2+,验证了假设1的成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2。请写出在酸性条件下NO3-氧化Ag的离子方程式: 。并帮乙同学完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生,乙同学放弃了检验NO3-在不同条件下的还原产物的方法)。
| 实验步骤(不要求写具体操作过程) |
预期现象和结论 |
| ①测定上述实验用的Fe(NO3)3溶液的pH值 |
|
| ② |
某同学设计了以下流程来检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。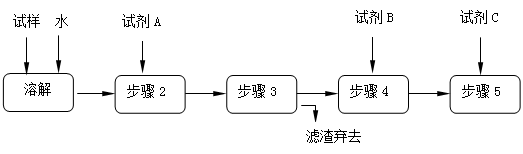
(1)溶解所需玻璃仪器是;步骤3的操作名称是
(2)对检验碳酸钠粉末中可能含有的杂质提出合理假设:
假设1:只含有氯化钠
假设2:只含有
假设3:氯化钠和氢氧化钠都含有
(3)设计实验方案,进行试验。
限选以下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。回答下列问题:
①加入过量试剂A的名称是_______________________。
②填写下表:
| 实验步骤 |
预期现象和结论 |
| 步骤4: |
|
| 步骤5: |
炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下: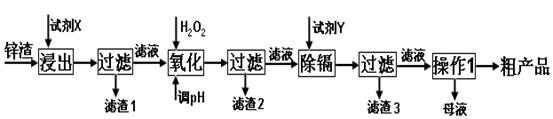
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强;SiO2是不溶于水和酸(HF除外)的酸性氧化物。
试回答下列问题:
(1)“浸出”时用到的“试剂X” 选。
A.H2SO4(aq) B.HCl(aq) C.HNO3(aq)
“滤渣1”的主要成分是 _(填化学式)。
(2)写出“氧化”过程的离子方程式。
(3)“调pH”过程可以选用。
A.H2SO4 B.ZnO C.NaOH
(4)“试剂Y” 选______________。
A.Cd B.Zn C.Fe
(5)“操作1”的方法是_____、______、_______。
下图为某实验小组的同学制备乙烯及验证乙烯性质的部分装置图,请回答:
(1)烧瓶中加入的两种试剂是__________________________;
(2)温度计的作用是____________________,碎瓷片的作用是_________________________;
(3)写出实验中产生乙烯的化学方程式:_____ __;
(4)甲同学认为:溴水褪色的现象不能证明乙烯具有不饱和性,其原因是烧瓶中液体呈棕黑色而产生_____________气体。乙同学经过仔细观察后认为:试管中另一个现象可证明乙烯具有不饱和性,这个现象是 ________________。丙同学为验证这一反应是加成而不是取代,提出了将杂质气体吸收后,可用pH试纸来测试反应后溶液的酸性,理由是____________________________________;
(5)处理上述实验中烧瓶内废液的正确操作是_______________。
| A.废液直接倒入下水道 |
| B.废液倒入空废液缸中 |
| C.将水倒入烧瓶中 |
| D.废液倒入盛有水的塑料桶中,经处理后再倒入下水道 |
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。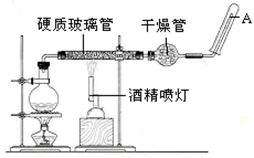
(1)写出该反应的化学方程式,其中氧化剂是, 8.4g铁粉参加反应,转移电子mol。
(2)干燥管内使用的干燥剂可以是下列物质中的(填序号)。
①浓硫酸②碳酸钠③碱石灰④过氧化钠
(3)硬质玻璃管中石棉绒的作用是,圆底烧瓶中盛装水和,加入后者的作用是。
(4)实验开始时应先点燃,实验结束时应先熄灭,检验生成的气体的方法是。