应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。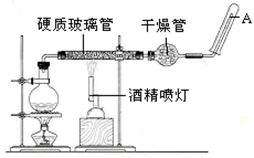
(1)写出该反应的化学方程式 ,其中氧化剂是 , 8.4g铁粉参加反应,转移电子 mol。
(2)干燥管内使用的干燥剂可以是下列物质中的 (填序号)。
①浓硫酸 ②碳酸钠 ③碱石灰 ④过氧化钠
(3)硬质玻璃管中石棉绒的作用是 ,圆底烧瓶中盛装水和 ,加入后者的作用是 。
(4)实验开始时应先点燃 ,实验结束时应先熄灭 ,检验生成的气体的方法是 。
实验室用下图装置制取少量溴苯,试填写下列空白。
(1)在烧瓶a中装的试剂是、、。
(2)请你推测长直导管b的作用:一是,二是 的作用。
(3)请你分析导管c的下口可否浸没于液面中?为什么?
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有褐色不溶于水的液体,这可能是因为 的缘故。简述获得纯净的溴苯应进行的实验步骤:
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物物分子式的常用装置。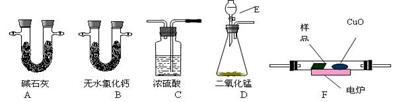
 (1)现准确称取0.44 g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88 g,B管增重0.36g。请回答:(1)按上述所给的测量信息,装置的连接顺序应是
(1)现准确称取0.44 g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88 g,B管增重0.36g。请回答:(1)按上述所给的测量信息,装置的连接顺序应是 ;
;
(2)A、B管内均盛有有固态试剂,A管的作用是_________;
(3)E中应盛装什么试剂:_________;
(4)如果把CuO网去掉,A管重量将_______;(填“增大”、“减小”、或“不变”)
(5)请改进这套装置的一个不足之处;(6)该有机物的实验式为_____________;
(7)要确定该有机物的分子式,还必须知道的数据是___________。(填编号)
①消耗液体E的质量②样品的摩尔质量③ CuO固体减少的质量④ C装置增加的质量
⑤燃烧消耗O2的物质的量
(共16分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。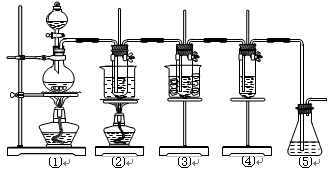
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:____________________________。
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。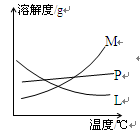
(3)本实验中制取次氯酸钠的离子方程式是______________________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 |
原因 |
| 溶液最初从紫色逐渐变为_______色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
_______________________________ |
| 然后溶液从无色逐渐变为_______色 |
_______________________________ |
(共14分)已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、CO32-。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成;
②D和B反应生成的气体能被A吸收;
③A和D反应生成的气体能被B吸收。
试回答下列问题:
(1)D的化学式是,判断理由是。
(2)写出其余几种物质的化学式:A,B,C。
(3)写出实验②中有关反应的离子方程式
。
超细铜粉主要应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:
试回答下列问题:
(1)下列关于[Cu(NH3)4]SO4的说法中,正确的有__________。(填字母序号)
| A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键 |
| B.[Cu(NH3)4]SO4含有NH3分子,其水溶液中也含有NH3分子 |
| C.[Cu(NH3)4]SO4的组成元素中第一电离能最大的是氧元素 |
| D.[Cu(NH3)4]SO4的外界离子的空间构型为正四面体 |
(2)NH4CuSO3中的金属阳离子的核外电子排布式为_______________。
(3)SO2–3 离子中S硫原子的杂化方式为________,与其互为等电子体的一种分子的分子式是___________。
(4)NH3易液化的原因是___________________。
(5)右图是铜的某种氧化物的晶胞结构示意图,由此可确定该氧化物的化学式为__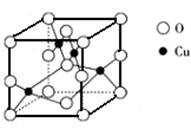 ___________。
___________。
(6)NH4CuSO3与硫酸微热反应的离子方程式为__________________________。