下列各组离子在给定条件的溶液中可能大量共存的是:
| A.加入铝粉有大量氢气产生的溶液中:Ca2+、K+、NO3-、C1- |
| B.PH = 0的无色溶液中:Na+、K+、MnO4-、NO3- |
| C.在0.1mol/L的醋酸溶液中:Fe2+、Na+、ClO-、Ca2+ |
| D.在c(OH-)= 1×10-13的溶液中:NH4+、Ca2+、C1-、K+ |
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下: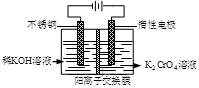
下列说法不正确的是
| A.在阴极室,发生的电极反应为:2H2O+2e—=2OH—+H2↑ |
| B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为H+浓度增大,使平衡 2CrO42—+2H+  Cr2O72—+H2O向右移动 Cr2O72—+H2O向右移动 |
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑ 2K2Cr2O7+4KOH+2H2↑+O2↑ |
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr )为d,则此时铬酸钾的转化率为1- |
下列说法正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L—1盐酸、③0.1 mol·L—1氯化镁溶液、④0.1 mol·L—1硝酸银溶液中,Ag+浓度:①>④=②>③ |
| D.用0.2000 mol·L—1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol·L—1),至中性时,溶液中的酸未被完全中和 |
锰酸锂离子蓄电池是第二代锂离子动力电池。它的问世使得锂离子动力电池在纯电动汽车与混合动力车等大型蓄电池应用领域占据主导地位。电池反应式为:Li1-xMnO4+LixC  LiMnO4+C。
LiMnO4+C。
下列有关说法正确的是
A.充电时电池内部Li+向正极移动
B.放电过程中,电能转化为化学能
C.放电时电池的正极反应式为:Li1-xMnO4+xe—+xLi+=LiMnO4
D.充电时电池上标注有“+”的电极应于外接电源的负极相连
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。五种元素核电荷数之和为54,最外层电子数之和为20。W、Z最外层电子数相同,Z的核电荷数是W的2倍。工业上一般通过电解氧化物的方法获得Y的单质。则下列说法不正确的是
| A.原子半径:X>Y>Q>W |
| B.Q和W可形成原子个数比为1∶1和2∶1的化合物 |
| C.Q和Z所形成的分子空间构型为直线形 |
| D.X、Y和W三种元素形成的化合物的水溶液呈碱性 |
下列说法不正确的是
| A.除去N2中的少量O2:通过灼热的Cu粉,收集气体 |
| B.铅蓄电池在放电时,Pb作为负极,不断转化为PbSO4 |
| C.用盐酸酸化KMnO4溶液可以增强其氧化性 |
| D.强电解质在水中溶解度不一定大于弱电解质在水中的溶解度 |