、、、是元素周期表前四周期中的四种常见元素,其相关信息如下表;
| 元素 |
相关信息 |
| 的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
| 常温常压下,单质是淡黄色固体,常在火山口附近沉积 |
|
| 和同周期,的电负性大于 | |
| 的一种核素的质量数为63,中子数为34 |
(1) 位于元素周期表第周期第)族,和最高价氧合物对应的水化物的酸性较强的是(化学式)
(2是一种常用的溶剂,的分子中存在个键。在,两种共价键中,键的极性较强的是,键长较长的是。
(3)的基态原子核外电子排布式是。在空气中煅烧生成的化学方程式是。
(4)处理含验到气污染的一种方法,是将其在催化剂作用下转化为单质。
已知:
此反应的热化学方程式是
(14分)三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(镍铁钙镁合金为主)制取草酸镍,再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐难溶于水。根据下列工艺流程示意图回答问题。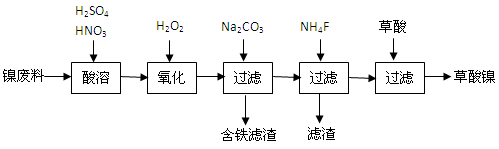
(1)生产过程中多次进行过滤。实验室进行过滤操作中用到玻璃棒,玻璃棒的作用是。
(2)加入过氧化氢后缓慢加入碳酸钠溶液调pH至4.0~4.5左右,加入碳酸钠溶液的作用是。再加入NH4F的目的是。
(3)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧三小时,制得三氧化二镍,同时获得一种混合气体。写出草酸镍受热分解的化学方程式。
(4)工业上还可用电解法制取三氧化二镍。用NaOH溶液调节NiCl2溶液pH至7.5,加入适量硫酸钠后采用惰性电极进行电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。写出ClO-氧化Ni(OH)2生成三氧化二镍的离子方程式。a mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是。
(5)电解法制取三氧化二镍实际过程中,有时获得一种结晶水合物,已知1mol该物质中含有0.5 mol结晶水。取该化合物20.2 g进行充分加热,而获得三氧化二镍固体和0.2 mol水,则该结晶水合物的化学式为。
Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:
(1)该合成路线对于环境保护的价值在于。
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因。
(3)CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:。
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
(4)该反应的焓变△H0,熵变△S___0(填>、<或=)。
(5)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式。若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜g。
4-硫醚基喹唑啉类化合物是一种具有应用前景的抑菌药物,其合成路线如下: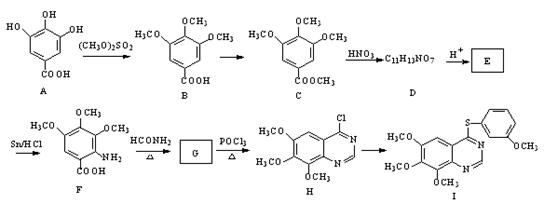
已知:
(1)A中含氧官能团的名称是;E→F的应类型为。
(2) C的一种同分异构体X,X是苯的衍生物,苯环上有四个取代基,其中3个为甲氧基(-OCH3),在苯环上的位置与C相同,每摩X最多能与2 mol NaOH反应。X的结构简式为。
(3)写出C→D的化学方程式。
(4)物质G的结构简式为。
(5)利用题给相关信息,以甲苯、HCONH2为原料,合成 。合成过程中无机试剂任选;合成路线流程图示例为:
。合成过程中无机试剂任选;合成路线流程图示例为:
提示: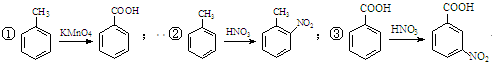
某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色:J分子内有两个互为对位的取代基。在一定条件下有如下的转化关系:(无机物略去)
(1)A物质的结构简式为:________________。写出三种属于芳香烃类的A的同分异构体_____________、____________、___________________。(不包括A,写结构简式)
(2)J中所含的含氧官能团的名称为_____________________________________。
(3)F →H反应的化学方程是;
反应类型是。
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的名称是_______________。
(12分)屠呦呦,药学家,中国中医研究院终身研究员兼首席研究员,青蒿素研究开发中心主任。多年从事中药和中西药结合研究,突出贡献是创制新型抗疟药———青蒿素和双氢青蒿素。2011年9月,获得被誉为诺贝尔奖“风向标”的拉斯克奖。这是中国生物医学界迄今为止获得的世界级最高级大奖。
已知甲基环己烷结构简式如图一,也可表示为图二的形式。抗虐新药青蒿素的结构简式如图三所示。其中过氧基(—O—O—)具有强氧化性,可消毒杀菌。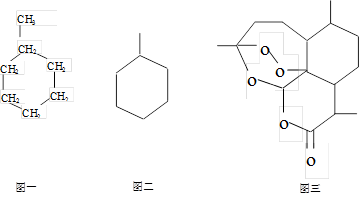
根据所学知识回答有关问题:
(1)写出青蒿素的分子式。
(2)下列有关青蒿素的叙述正确的是()
A.青蒿素是芳香族含氧衍生物 B.青蒿素具有强氧化性,可消毒杀菌
C.青蒿素属于酚类、酯类衍生物 D.1mol青蒿素水解消耗2molNaOH
(3)人工合成青蒿素的关键技术是以天然香草醛为原料,解决架设过氧桥难题。能在有机合成中引入羟基的反应类型有()
①取代②加成③消去④酯化⑤还原
A.②③ B.①②⑤ C.①④ D. ①②③⑤
(4)一种天然香草醛的结构简式为: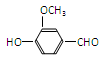 ,有关反应过程如下:
,有关反应过程如下: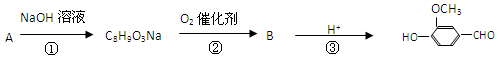
①步骤①③的作用是。
②写出下列物质的结构简式AB。