为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行试验(夹持仪器已略去,气密性已检验)。

试验过程:
Ⅰ.打开弹簧夹,打开活塞,滴加浓盐酸。
Ⅱ.当和中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当中溶液由黄色变为棕色时,关闭活塞。
Ⅳ………
(1)中产生黄绿色气体,其电子式是。
(2)验证氯气的氧化性强于碘的实验现象是。
(3)中溶液发生反应的离子方程式是。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是。
(5)过程Ⅲ实验的目的是。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,得电子能离逐渐减弱。
某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如下图所示: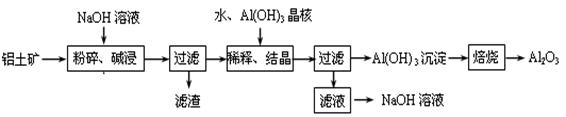
(1)粉碎后的铝土矿碱浸时应在高温下进行,其目的是 。碱浸时AlO(OH)与NaOH反应的化学方程式为 。滤渣的主要成分为 (填化学式)。
(2)上述“稀释、结晶”工艺后,溶液的pH将 (填“增大”、“减小”或“不变”)。
也可用通入足量的CO2气体的方法来代替,其原因是 (用离子方程式表示)。
(3)在空气中浓缩所得的NaOH溶液,得到的浓溶液中会混有杂质,该杂质可能为 。
铁及其合金在生活中用量极大,请回答下列问题:
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室用硫酸厂的烧渣(主要成份是Fe2O3及少量的FeS和SiO2制备绿矾。利用烧渣制备绿矾的流程如下:
(1)写出生成硫单质的化学方程式:
向溶液X加入足量铁屑所发生的离子方程式是:
(2)为了检验绿矾产品的FeSO4是否含有三价铁离子,所用的试剂是:
配制FeSO4溶液时,所用的蒸馏水需煮沸的原因是:
(3)溶液Y经操作①②可得绿矾晶体,则操作I是 ,操作II是 ,过滤 。
(4)镀铜可以防止铁制品的腐蚀,电镀时镀层金属是: ,阴极的反应式是:
(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.4kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5kJ·mol-1
写出当有1molCO反应时,理论上CO(g)还原FeO(s)所吸收的能量是:
(2)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。某同学设计了三组实验,实验条件已经填在下面实验设计表中。2NO + 2CO⇋N2 + 2CO2 △H< 0
| 实验编号 |
T(℃) |
NO初始浓度 (mol/L) |
CO初始浓度 (mol/L) |
催化剂的比表面积(m2/g) |
| Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
| Ⅱ |
280 |
1.20×10-3 |
5.80×10-3 |
124 |
| Ⅲ |
350 |
1.20×10-3 |
5.80×10-3 |
124 |
①以上三组实验的实验目的是 。
②请在给出的坐标图中,画出上表中的第三个实验条件
下混合气体中NO浓度随时间变化的趋势曲线图。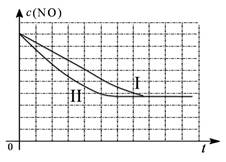
(3)汽车内燃机工作时引起反应:N2(g)+O2(g)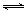 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数K及N2的转化率(写出计算过程)。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数K及N2的转化率(写出计算过程)。
这个方法合成托品酮,在有机合成史上具有重要意义。
已知:碳碳双键上的羟基不稳定。
(1)下列说法,不正确的是 。
| A.1mol化合物Ⅲ最多能和3molH2发生加成反应 |
| B.1mol化合物Ⅰ发生银镜反应时,将生成2molAg |
| C.化合物Ⅰ经加成后可以和氢溴酸反应 |
| D.1mol化合物Ⅲ最多能与2molNaOH反应 |
(2)化合物Ⅳ的分子式是: 1mol该物质完全燃烧消耗的氧气 mol(假设燃烧后氮元素的存在形式为氮气)
(3)合成化合物Ⅲ可以由 ;由丙酮与光气反应制得,则此反应属于 反应,丙酮的一种同分异构体Ⅵ能与钠反应产生氢气,它的结构简式是: ;要催化氧化的条件下,化合物Ⅵ可以氧化成能发生银镜反应的化合物Ⅶ,该反应的方程式是 (不用注明反应条件)
;由丙酮与光气反应制得,则此反应属于 反应,丙酮的一种同分异构体Ⅵ能与钠反应产生氢气,它的结构简式是: ;要催化氧化的条件下,化合物Ⅵ可以氧化成能发生银镜反应的化合物Ⅶ,该反应的方程式是 (不用注明反应条件)
(4)上述的化合物Ⅶ再氧化后,所得的产物与乙醇反应,所得的产物经加聚后得到高分子化合物Ⅷ的结构简式是: 。
铝是自然界中含量最高的金属元素,以铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)为原料通过以下途径制备氯化铝晶体:
(1)X是__________(填名称)。
(2)已知Y是氧化铝,目的是调节溶液的pH,根据下表数据,溶液的pH应保持在_______范围。
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ |
1.9 |
3.2 |
| Al3+ |
4.0 |
5.2 |
(3)检验滤液C中既不存在Fe2+又不存在Fe3+的操作步骤是: (注明试剂、现象)。
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。
(5)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝。电镀是钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。不用AlCl3水溶液作电解液的原因是 。