(1)中国古代四大发明之一--黑火药,它的爆炸反应为:

①除外,上列元素的电负性从大到小依次为
②在生成物中,的晶体类型为
③已知与结构相似,推算分子中键与键数目之比为
(2)原子序数小于36的元素和,在周期表中既处于同一周期又位于同一族,且原子序数比多2。的基态原子外围电子(价电子)排布为
(3)在的水溶液中,一定条件下存在组成为(和均为正整数)的配离子,将其通过氢离子交换树脂(),可发生离子交换反应:
交换出来的经中和滴定,即可求出和,确定配离子的组成。
将含0.0015 的溶液,与完全交换后,中和生成的需浓度为0.1200溶液25.00,呆知该配离子的化学式为
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学程式为______________。
(2)若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的化学式为 ___________________.
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)___________________。
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为________________。
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根离子外还存在的阴离子为___________ (填化学式)。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为____________________________.
(7)若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成。则A生成B的化学方程式是_________________。
研究化学反应原理对生产生活很有意义,请用化学反应原理的相关知识回答下列问题: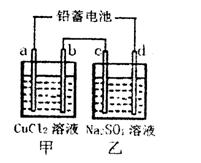
(1)用铅蓄电池电解甲、乙两电解池中的溶液。已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)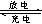 2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是______
2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是______ ______
______
(填写序号)
| A.d极为阴极 |
| B.若利用甲池精炼铜,b极应为粗铜 |
| C.放电时铅蓄电池负极的电极反应式为: PbO2(s)+4H+(aq)+ 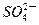 (aq)+4e- (aq)+4e- PbSO4(s)+2H2O(1) PbSO4(s)+2H2O(1) |
| D.若四个电极材料均为石墨,当析出6.4g Cu时,两池中共产生气体3.36L(标准 |
状况下)
(2)某二元酸H2A在水中的电离方程式是:H2A=H++HA-;HA- H++A2-,请回答下列问题:
H++A2-,请回答下列问题:
①Na2A溶液显_________(填“酸性”、“中性”或“碱性”),理由是________________
(用离子方程式表示)。
②已知0.1 mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.
mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.
(3)二甲醚是一种重要的清洁燃料,利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g); △H=-90.8kJ·mol-1
CH3OH(g); △H=-90.8kJ·mol-1
②2 CH3OH(g)
CH3OH(g) CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g);△=-41.3kJ·mol-1
CO2(g)+H2(g);△=-41.3kJ·mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式___________________.
(4)SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为:2SO2(g)+O2(g) 2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数.
(1)m g铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因
是:①常温下碳与浓硫酸不反应;②_____________。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式____________。
(3)B中的现象是:____________;C的作用是:_______________。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。则铁碳合金中铁的质量分数为_____________。
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:___________。
(6)最后对所得测量结果进行评价,小 组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低的是(任答一条即可)
组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低的是(任答一条即可)
_____________。
( 10分)已知:
10分)已知: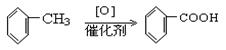
有机物E和F可作塑料的增塑剂或涂料的增塑剂,它们 的分子量相等。它们可以用下图的方法合成。
的分子量相等。它们可以用下图的方法合成。
(1)写出结构简式:B、D 。
。
(2)写出反应方程式:A+C→E :。
(3)反应⑤的类型:。
(4)E和F的相互关系是()
| A.同分异构体 | B.同一种物质 | C.同一类物质 | D.同系物 |
(1)除去杂质所需的试剂(括号里为杂质)
苯(苯酚)乙烷(乙烯)
(2)有机物A的分子式为C6H12O2它有如图性质变化,若C、 E均不能发生银镜反应,则A的可能结构简式为或。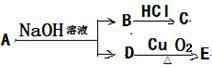
(3) 乳酸( )在一定条件下生成聚乳酸的反应方程式
)在一定条件下生成聚乳酸的反应方程式