工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)另称取铁钉6.0放入15.0.浓硫酸中,加热,充分应后得到溶液并收集到气体。
①甲同学认为中除外还可能含有。若要确认其中的,应先用选填序号)。
a.溶液和氯水 b.铁粉和溶液 c.浓氨水 d.酸性溶液
②乙同学取336(标准状况)气体Y通入足量溴水中,发生反应:
然后加入足量溶液,经适当操作后得干燥固体2.33。由于此推知气体中的体积分数为。
[探究二]
分析上述实验中体积分数的结果,丙同学认为气体Y中还可能含量有和气体。为此设计了下列探究实验状置(图中夹持仪器省略)。

(3)装置中试剂的作用是
(4)认为气体中还含有的理由是(用化学方程式表示)。
(5)为确认的存在,需在装置中添加于(选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体中含有,预计实验现象应是
(7)若要测定限定体积气体中的含量(标准状况下约有28 ),除可用测量体积的方法外,可否选用质量称量的方法?做出判断并说明理由。
a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化: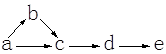
其中: a是单质;b是气体;c、d是氧化物;e是含氧酸。
(1)如果a是一种淡黄色粉末固体,试推断这五种物质(用化学式表示):
a;b;c;d;e。
(2)如果a是一种常见气体,试推断这五种物质(用化学式表示):
a;b;c;d;e。
t℃时,将3 mol A和1 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3 A(g)+B(g)  xC(g),2min时反应达到平衡状态(温度不变),剩余了O.8 mol B,并测得C的浓度为O.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了O.8 mol B,并测得C的浓度为O.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为;
(2)x=_______;
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) ()
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充人a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)=mol;
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为。
某研究性学习小组探究用氯化铁溶液腐蚀印刷电路铜箔板,请你选用烧杯、氯化钾琼脂盐桥(必用)及导线、电极(自选)、电解质溶液(自选)若干(若缺少可自行添加)。
(1)在下面空白处画出装置图,指出电极和电解质名称
__________________________________________________________。
(2)该小组有一成员突发奇想:用该装置测阿伏伽德罗常数。给你天平、秒表、烘箱,你觉得还缺少的一个必须测量仪器是__________,已知被腐蚀铜箔的质量为m克,每个电子的电量为q库伦,铜箔腐蚀时间为t秒,你选用的测量仪器在测量时间内为x“单位”,其“单位”也为国际单位,不考虑其它误差因素,则阿伏伽德罗常数的计算式=___________。
(1)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈,溶液中c(CH3COO-)c(Na+)。(填大于、小于、等于)
(2)将pH=3的硫酸溶液和pH=12的氢氧化钠溶液混和,若使混和后溶液的pH=7,则硫酸溶液和氢氧化钠溶液的体积比是_______
(3)某酸性化工废水中含有浓度约为0.01mol.L-1的Ag+、Pb2+等重金属离子。有关数据如下:
| 难溶电解质 |
AgI |
AgOH |
Ag2S |
PbI2 |
Pb(OH)2 |
PbS |
| Ksp |
8.3×10-12 |
5.6×10-8 |
6.3×10-50 |
7.1×10-9 |
1.2×10-15 |
3.4×10-28 |
(i)在废水排放前,用沉淀法除去这两种离子, 最好加入_________(填字母序号)
A. Na2S、 B. NaOH 、 C.KI、 D.Ca(OH)2
(ii)某工程师用CaO处理上述废水后Pb2+的浓度为1.2×10-3 则此溶液的pH=____。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)请写出:元素o的基态原子电子排布式_________
(2)k在空气中燃烧产物的分子构型为,中心原子的杂化形式为,该分子是(填“极性”或“非极性”)分子。
(3)含10电子的d的氢化物分子的VSEPR模型为_______。元素c、a、e按原子个数1:2:1组成生活中常见有甜味分子,该分子中有___个手性碳原子。
(4)g、h、i三种元素的第一电离能由大到小的顺序为________(填元素符号)
(5) 所有元素 其中电负性最大的是___(填图中的序号或元素符号),元素k有两种氧化物,它们对应的水化物的酸性强弱顺序为__________;(填化学式)