是一种可降解的聚碳酸酯类高分子材料,由于其具有优良的耐冲击性和韧性,因而得到了广泛的应用。以下是某研究小组开发的生产的合成路线:

已知以下信息:
①可使溴的溶液褪色;
②中有五种不同化学环境的氢;
③可与溶液发生显色反应:
④不能使溴的褪色,其核磁共振氢谱为单峰。
请回答下列问题:
(1)的化学名称是;
(2)的结构简式为;
(3)与反应生成E的化学方程式为;
(4)有多种同分异构体,其中能发生银镜反应的是(写出结构简式);
(5)的同分异构体中含有苯环的还有种,其中在核磁共振氢谱中出现丙两组峰,且峰面积之比为3:1的是(写出结构简式)。
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(1)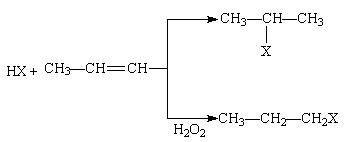 (X为卤素原子)
(X为卤素原子)
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为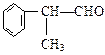 的物质,该物质是一种香料。
的物质,该物质是一种香料。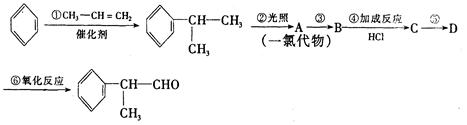
请根据上述路线,回答下列问题:
(1)A的结构简式可能为____________________________________。
(2)反应①、③、⑤的反应类型分别为________、________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
______________________________________________。
(4)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):
____________________________________________________________。
已知:①R— —
—
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯作原料制备一系列化合物的转化关系图:
(1)A转化为B的化学方程式是_______________________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________________,②____________________________。
(3)B在苯环上的二氯代物有种同分异构体。
(4)有机物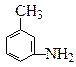 的所有原子(填“在”或“不在”)同一平面上。
的所有原子(填“在”或“不在”)同一平面上。
正盐A能发生下图所示的反应,图中①~⑧分别代表有关反应中的一种物质(某些物质已略去),其中①、②、④、⑤为无色气体。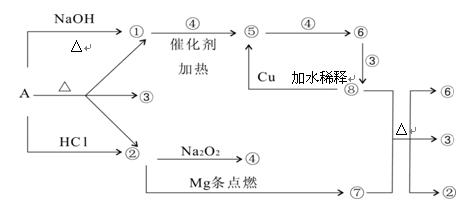
请完成下列各题:
(1)写出化学式A ⑥ ⑦
(2)写出下列反应方程式:
⑧+⑦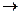 ②+③+⑥:
②+③+⑥:
①+④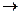 ⑤:
⑤:
(3)⑧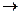 ⑤的离子方程式为:
⑤的离子方程式为:
把正确答案序号填写在题中的横线上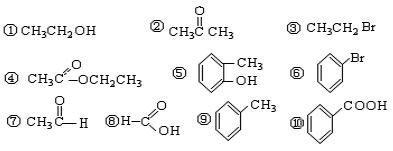
以上属于下列种类的是:
(1)芳香烃:;(2)卤代烃:;(3)醇:;
(4)酚:;(5)醛:
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2 (g) + 3 H2(g) 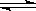 2NH3(g)
2NH3(g)
⑴若反应达平衡时某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
⑵反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平移时NH3的物质的量。
⑶原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
⑷原混合气体中,a∶b = 。
⑸达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= 。
⑹平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。