鸦片具有复杂的组成,其中所含罂粟碱分子结构如图,由其分子结构可推知下列关于罂粟碱的叙述中正确的是( )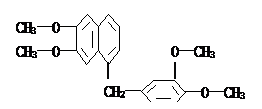
| A.其分子式为C23H22O4 |
| B.罂粟碱属芳香酯类 |
| C.1 mol罂粟碱可与8mol氢气完全加成 |
| D.其苯环上的一溴取代物有6种结构 |
含溶质的质量分数相同的浓氨水(密度ρ<1 g·mL-1)和浓NaOH(ρ>1 g·mL-1),各取50 mL分别与等体积水混合,所得稀氨水质量分数为a%,稀NaOH质量分数为b%,则a与b关系正确的是()
| A.a>b | B.b>a |
| C.a="b" | D.不能确定 |
将NH4HCO3置于干的试管中加热,并使放出的气体依次通过盛有过氧化钠和碱石灰的干燥管,最后得到的气体有()
| A.NH3,O2 | B.H2O,O2 |
| C.CO2,O2 | D.O2 |
一氯氨(NH2Cl)中氨基离子带负电荷,推测它跟水反应的最初生成物是()
| A.NH3和HClO | B.NH2OH和HCl |
| C.NH3·H2O和HCl | D.NH3和HClO3 |
图1-7中,锥形瓶内盛有气体X,滴管内盛有液体Y。若挤压胶头滴管,使液体Y滴入瓶中,振荡,过一会儿可见小气球a鼓气。气体X和液体Y不可能是()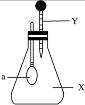
图1-7
| A.X是NH3,Y是水 |
| B.X是SO2,Y是NaOH浓溶液 |
| C.X是CO2,Y是稀硫酸 |
| D.X是HCl,Y是NaNO3稀溶液 |
跟氨分子所含的质子总数和电子总数都相同的粒子是()
| A.Na+ | B.Mg2+ | C.HCl | D.HF |